免疫疗法代表了癌症治疗方法的重大飞跃,但是仍有部分患者因药物有效率低无法得到有效的治疗。合适的临床前药效研究模型,可以加速免疫药物研发和开发新型治疗组合,最大程度减少临床试验失败。基因人源化小鼠和免疫系统人源化小鼠可谓啮齿动物界的“两大神兽”,深受药物研究者的青睐。为了更大限度的模拟人体疾病与免疫系统的相互作用,研究者在免疫缺陷小鼠体内移植入人造血干细胞或功能性的淋巴细胞,使其具有人的免疫功能,称为免疫系统人源化小鼠/免疫系统重建小鼠。它在肿瘤免疫治疗药物的研发与临床前评估方面也颇有前景。
依据人免疫系统重建的方法,将免疫系统人源化小鼠模型分为三类:Hu-PBL(human peripheral blood lymphocyte)/Hu-PBMC(human peripheral blood mononuclear cell)、Hu-CD34+HSC( human hematopoietic stem cell )和Hu-BLT(human bone marrow, liver and thymus )小鼠模型,表1[1]展示不同小鼠模型构建方法及特点。
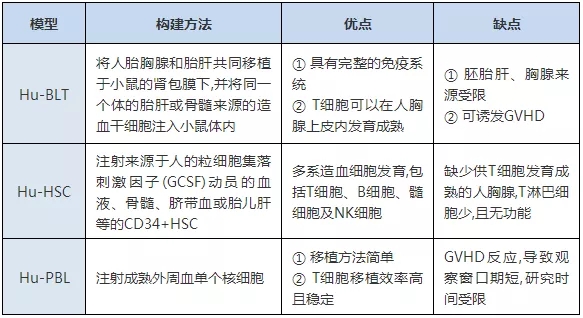
注:Hu-PBL:人外周血淋巴细胞;Hu-PBL/PBMC:人外周血单核细胞;Hu-Hu-CD34+HSC:人造血干细胞;Hu-BLT:人骨髓、肝脏、胸腺;GVHD:移植物抗宿主病
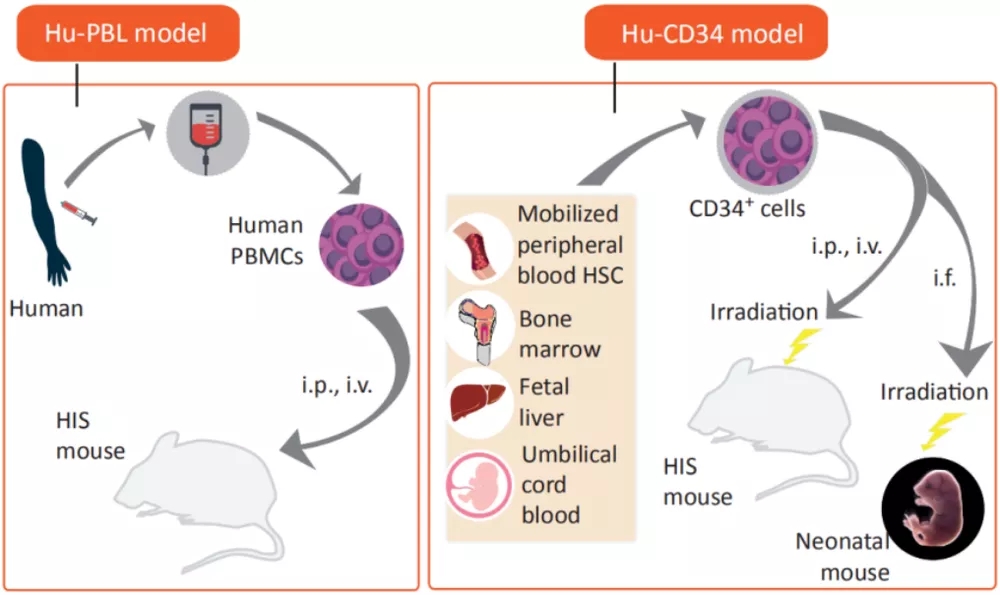
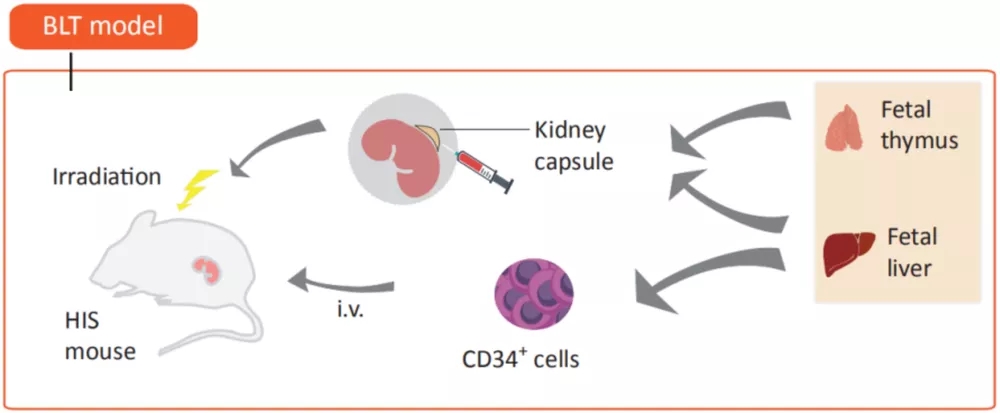
免疫系统人源化小鼠模型在免疫治疗和免疫研究中,特别是在肿瘤治疗上有重要作用,能够研究人免疫细胞介导的人体组织免疫排斥,评估药物的治疗潜力,也可以针对患者肿瘤提供治疗方案预测。多种新型疗法如细胞治疗、免疫检查点抑制剂治疗以及与其他免疫疗法组合等,都可以此作为临床前评价模型。
1)CAR-T治疗中的应用
CAR-T疗法是应用患者自身的T淋巴细胞,经嵌合抗原受体修饰,体外扩增后再次回输入患者体内,从而识别并攻击自身的肿瘤细胞。2017年美国食品药品监督管理局(FDA)批准了首项针对B细胞急性淋巴母细胞性白血病的CAR-T治疗,但是CAR-T在实体肿瘤的治疗中应用较少。目前免疫系统人源化小鼠模型已应用于各种CAR设计的抗肿瘤药效评估。
图2. CAR-T细胞治疗在免疫系统人源化肿瘤小鼠模型的临床前评估[3]
Daniel Abate-Daga等利用Hu-PBL模型评估 PSCA CAR-T细胞药效(图3),表明对胰腺癌患者有治疗潜力。2020年 Precigen公司在AACR年会上公布了PRGN-3005 UltraCAR-TTM的临床前结果,其对SK-OV-3卵巢癌模型有明显的特异性抗肿瘤作用。
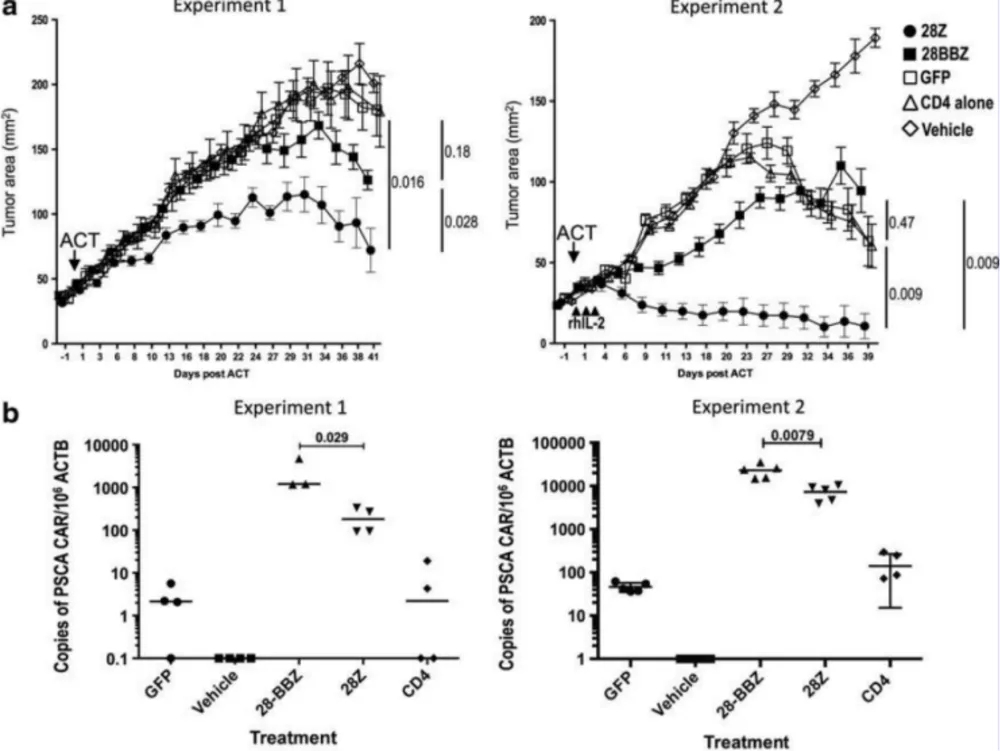
图3. PSCA CARs 有效治疗建立的肿瘤模型[4]
除此之外,免疫系统人源化小鼠还能对CAR-T细胞的部分毒性提供提示。Richman等试图引入抗GD2 scFv单点突变,以增加抗GD2 CAR-T细胞的效力。其在免疫系统人源化小鼠中显示出对人神经母细胞瘤的抗肿瘤活性增强,但肿瘤缩小更多的小鼠出现了重度脑毒性,在大脑中发现了CAR-T细胞强烈浸润出现,提示这一突变可能会引起安全问题[5]。NK细胞治疗以非特异性方式杀伤靶细胞,不具有诱导GVHD的风险,CAR-NK细胞可以提高其功能,诱导细胞因子风暴的风险较低,也在肿瘤治疗中显示出独特优势[3]。Neuroblastoma Model.Liu等分离脐带血来源的NK细胞,经CAR转导(编码抗CD19、IL-15(NK细胞持久性的关键细胞因子)和iC9**基因),利用免疫系统人源化小鼠评估发现其对Raji淋巴瘤具有较强的抗肿瘤效果;且在CAR-NK细胞具有毒性的情况下,能够通过激活**基因快速消除体内的CAR-NK细胞。该药物正在进行临床实验(NCT03690310)[6]。
免疫检查点抗体药物能够通过调节免疫系统进行肿瘤治疗,免疫系统人源化小鼠能够提供人体免疫细胞,通过肿瘤移植可以验证和评价单克隆抗体、双特异性抗体及联合用药的药效。PF-05082566(Utomilumab, Pfizer)是一种全人源IgG2,可与人4-1BB的胞外域结合,具有高亲和力和特异性。在临床前研究中,该激动剂抗体证明了其在人PBMC异种移植肿瘤模型中激活NF-jB并诱导下游细胞因子产生、促进白细胞增殖和抑制肿瘤生长的能力[7]。
图4. PF-05082566在体内抑制PC3前列腺肿瘤生长
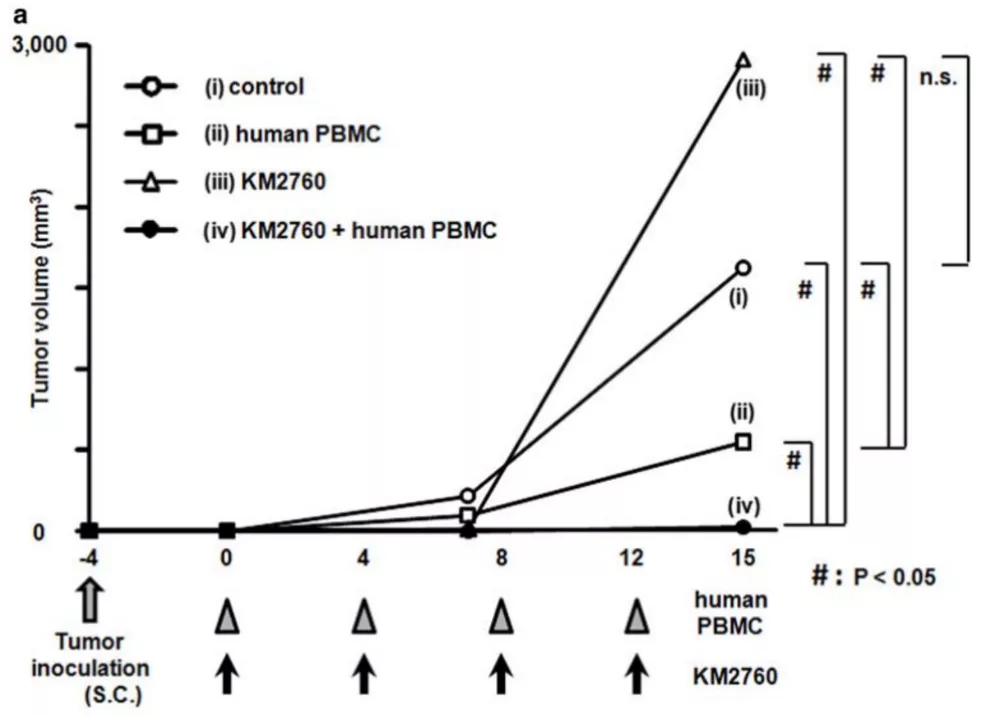
在血液瘤的临床领域,T细胞淋巴瘤的预后较差,研究者开发了新一代嵌合CCR4抗体(KM2760),改造后具有增强的ADCC活性。并且利用人PBMC重建小鼠模型研究了CCR4抗体针对霍奇淋巴瘤(HL)及肿瘤浸润淋巴细胞的强效ADCC作用,也在体内发现其具有良好的抗皮肤T细胞淋巴瘤(CTCL)药效效果。
图5.KM2760在Hu-PBMC CTCL模型体内有良好抗肿瘤活性[8]
此外,免疫系统人源化小鼠模型还可对双特异性抗体进行评价。再生元开发了全人源双特异性抗体REGN1979,能够靶向B细胞标记物CD20和T细胞受体的CD3成分,从而触发B细胞的重定向杀伤。研究者建立了Hu-PBMC Raji B细胞淋巴瘤模型,使用REGN1979治疗,结果表明在体内有强效抗肿瘤活性。
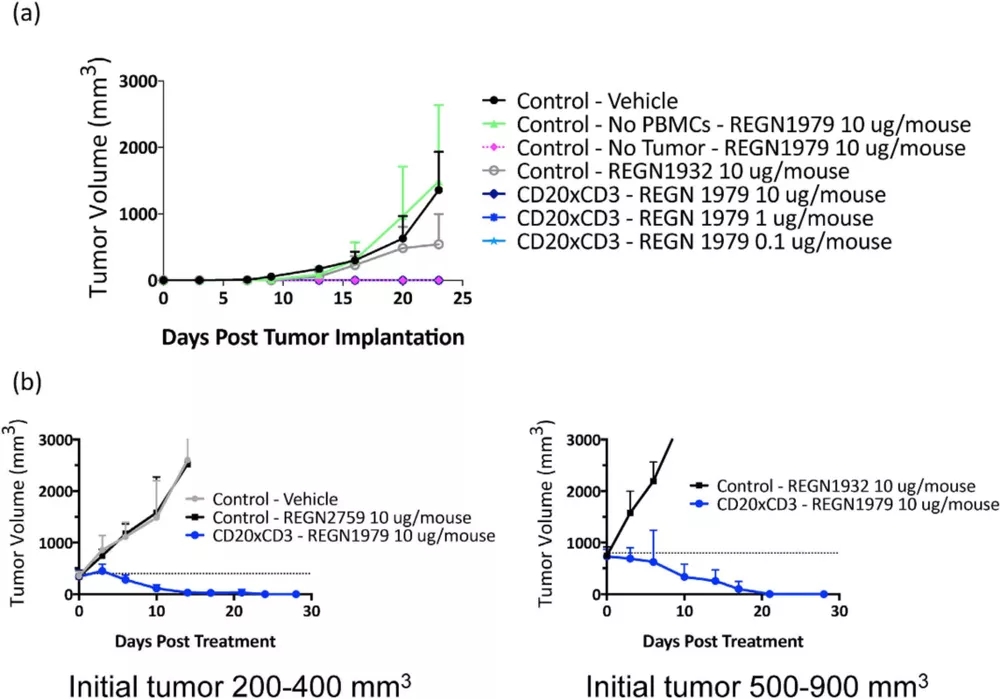
图6.REGN1979抑制小鼠体内肿瘤生长[9]
虽然免疫系统人源化小鼠模型在部分免疫治疗的研究中取的成功,但由于所用免疫细胞之间的供体差异[10],人源化小鼠针对免疫检查点抑制剂治疗的反应不尽相同,这与临床上患者对抗PD-1治疗的不同反应率是一致的。因此,人源化小鼠模型在肿瘤免疫治疗中的应用仍然需要进一步的探索和改进。免疫检查点肿瘤免疫疗法的成功,让人们对癌症治疗充满信心,但由于药物有效率的问题,科学家们继续开启了联合用药的研究之路。2019年3月美国FDA批准了PD-L1抑制剂 Atezolizumab 联合依托泊苷、卡铂用于广泛期小细胞肺癌患者的一线治疗,这标志着免疫治疗进入联合治疗为主的2.0时代。Suarez等[11]在转移性肾透明细胞癌(ccRCC)的人源化小鼠模型中使用CAR-T细胞和免疫检查点抑制剂进行联合治疗。这些靶向人抗碳酸酐酶IX(CAIX)的CAR-T细胞经改造后可分泌人抗PD-L1抗体,阻断PD-1和PD-L1相互作用。与仅使用CAR-T细胞处理组相比,联合免疫检查点阻断方法可有效增强抗肿瘤效力,可观察到PD-1、TIM-3和LAG-3表达降低。Wege等[12]的研究表明,曲妥珠单抗和IL-15联合使用可诱导HER2阳性乳腺肿瘤的消除,但也会导致与T细胞过度活