铁死亡(Ferroptosis )是一种铁依赖性的,区别于细胞凋亡、细胞坏死、细胞自噬的新型的细胞程序性死亡方式。铁死亡实质是膜脂修复酶失效,细胞内脂质氧化物代谢障碍,在铁离子催化作用下,造成膜脂上活性氧自由基(ROS)堆积,使细胞内氧化还原失衡,诱导细胞死亡。
铁死亡最初是在研究体外培养的肿瘤细胞中合成的小分子的细胞毒性作用而发现的[1]。这些小分子通过靶向胱氨酸摄取、谷胱甘肽(GSH) 合成、铁负载、谷胱甘肽过氧化物酶-4 (GPX4) 活性和铁死亡抑制蛋白-1 (FSP1) 人工诱导铁死亡[2]。越来越多的证据表明铁死亡可能与多种病理情况有关,包括急性肾损伤、组织缺血再灌注损伤、神经变性和癌症。然而这些条件下的自然铁死亡诱导机制仍然未知。
近期,来自密歇根大学医学院邹伟平团队在Cancer Cell 杂志发表题为“CD8+ T cells and fatty acids orchestrate tumor ferroptosis and immunity via ACSL4”的研究型文章,该文章发现T细胞衍生的干扰素 (IFN)γ与花生四烯酸(AA)结合可诱导肿瘤铁死亡[3]。

研究人员探索了IFNγ协同花生四烯酸诱导肿瘤细胞铁死亡的机制。酰基辅酶A合成酶长链家族成员4(ACSL4)将花生四烯酸激活为花生四烯酰辅酶A,后者被酯化为磷脂,外源性花生四烯酸可增强RSL3诱导的铁死亡。之前研究发现单独使用花生四烯酸不能直接引发肿瘤细胞铁死亡,而ACSL4是花生四烯酸协同IFNγ诱导肿瘤细胞发生铁死亡的关键酶。IFNγ通常由活化的T细胞和NK细胞产生,IFNγ与肿瘤微环境中发现的一种脂肪酸花生四烯酸结合,激活ACSL4,改变肿瘤细胞脂质模式,诱发肿瘤细胞铁死亡。IFNγ与花生四烯酸的组合直接引发人和小鼠肿瘤细胞的铁死亡,并作为CD8+T细胞介导的肿瘤杀伤的一种作用模式。
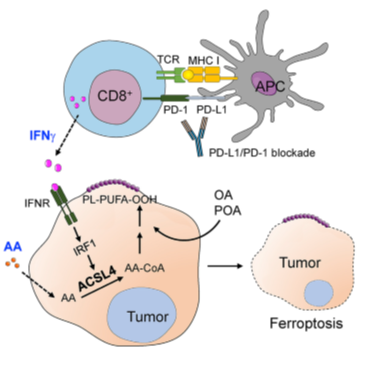
这项研究表明将γ干扰素与花生四烯酸结合起来,可以激活ACSL4,改变肿瘤细胞的脂质模式,并天然地诱导肿瘤细胞铁死亡。依赖于ACSL4的肿瘤铁死亡是杀伤性T细胞的一种作用模式,靶向ACSL4使癌症对免疫治疗敏感,是一种潜在的抗癌方法。
参考文献:
[1] Dixon, S.J., Winter, G.E., et al. Human haploid cell genetics reveals roles for lipid metabolism genes in nonapoptotic cell death. ACS Chem.Biol. 2015 10, 1604–1609.
[2] Doll, S., Freitas, F.P., Shah, R., et al.. FSP1is a glutathione-independent ferroptosis suppressor. Nature.2019 575, 693.
[3] Peng Liao, Weimin Wang, et al. CD8 + T cells and fatty acids orchestrate tumor ferroptosis and immunity via ACSL4.Cancer Cell.2022 Feb 15;S1535-6108(22)00036-8.doi: 10.1016/j.ccell.2022.02.003
