精神分裂症(Schizophrenia)是一种复杂而严重的精神疾患,其特征是感知现实的方式受到严重损害,出现持续性妄想、幻想、思维混乱及行为异常等,影响到全球约2400万人。精神分裂症患者病理变化包括少突胶质细胞分化受损、髓鞘和白质丢失等。
精神分裂症断裂基因1(Disrupted-in-schizophrenia-1, DISC1)被认为是精神分裂症发病的主要易感基因之一,研究发现,DISC1功能障碍参与影响少突胶质细胞前体细胞(oligodendrocyte precursor cells, OPCs)的成熟和髓鞘的形成。此外,DISC1的部分致病单核苷酸突变将导致DISC1的可变剪切增加,其中DISC1-Δ3(缺少外显子3的剪切体)在精神分裂症患者中显著升高,但其致病机制仍不清楚。
2022年9月21日,陆军军医大学牛建钦教授团队联合肖岚教授团队、曼切斯特大学Alexei Verkhratsky教授团队合作在Molecular Psychiatry上发表了题为“Pathological oligodendrocyte precursor cells revealed in human schizophrenic brains and trigger schizophrenia-like behaviors and synaptic defects in genetic animal model”的研究论文,揭示了OPCs中DISC1-Δ3表达通过调控Wnt/β-catenin信号通路异常激活与其下游Wif1高表达,参与精神分裂症发病机制。该研究找到一个临床干预精神分裂症的分子靶点—Wif1,并提供了强有力的实验依据。

结果
精神分裂症患者OPCs形态异常
首先,研究人员基于临床样本率先发现,精神分裂症(Schizophrenia)患者海马、前额叶皮层和杏仁核中被NG2标记的少突胶质细胞前体细胞(oligodendrocyte precursor cells, OPCs)的数量无明显变化,而形态发生改变,表现为更为复杂的肥大形态(图1)。
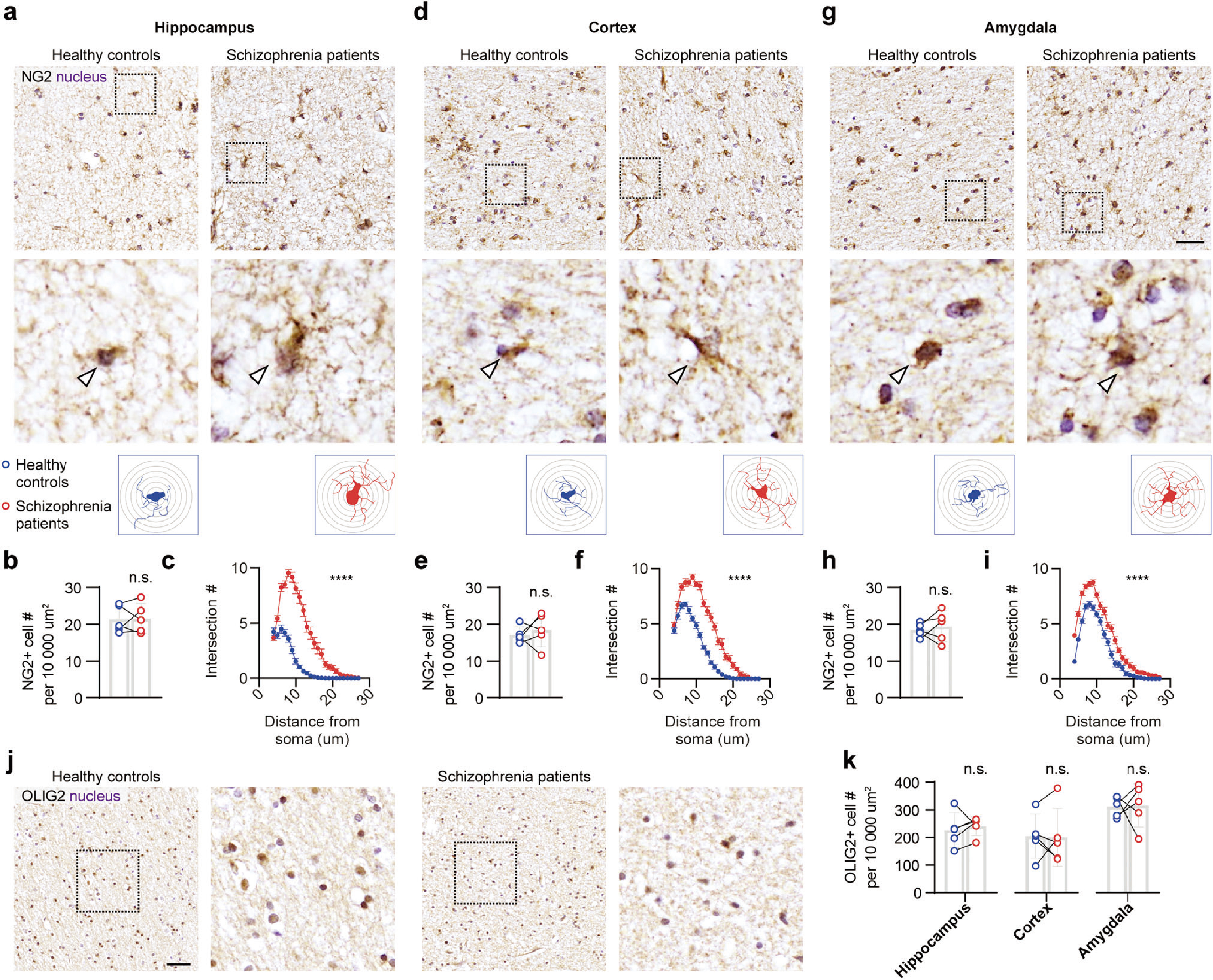
图1精神分裂症患者OPCs形态异常
DISC1-Δ3鼠模拟精神分裂症样表型
DISC1作为精神分裂症发病的主要易感基因之一,参与调节少突胶质细胞的发育,RNA测序结果显示,DISC1在人和小鼠OPCs的表达远高于少突胶质细胞和神经元。此外,对DISC1剪切体分析发现,DISC1-Δ3(缺少外显子3的剪切体)在精神分裂症患者脑中表达显著升高。 基于此,研究者构建NG2CreERT:DISC1exon3 fl/+小鼠(简称DISC1-Δ3鼠,由DISC1exon3 flox鼠与NG2CreERT鼠杂交获得,其特点为在不影响DISC1全基因表达情况下,经他莫昔芬诱导可特异性在OPCs中上调DISC1-Δ3的表达),发现OPCs中特异性过表达DISC1-Δ3同样导致OPCs过度肥大,并伴随着髓鞘形成减少(图2a-f),这与精神分裂症患者脑内OPCs形态类似(图1)。此外,行为水平上 ,出生后25-36(P25-P36)DISC1-Δ3鼠表现出精神分裂症样的感觉运动门控障碍(图2g-k)。同时,研究者发现DISC1-Δ3鼠海马CA1区兴奋性突触减少,且少突胶质细胞中DISC1-Δ3表达上调降低了自发兴奋性突触后电流(sEPSC)频率,增强了自发抑制性突触后电流(sIPSC)频率(图2l-p)。
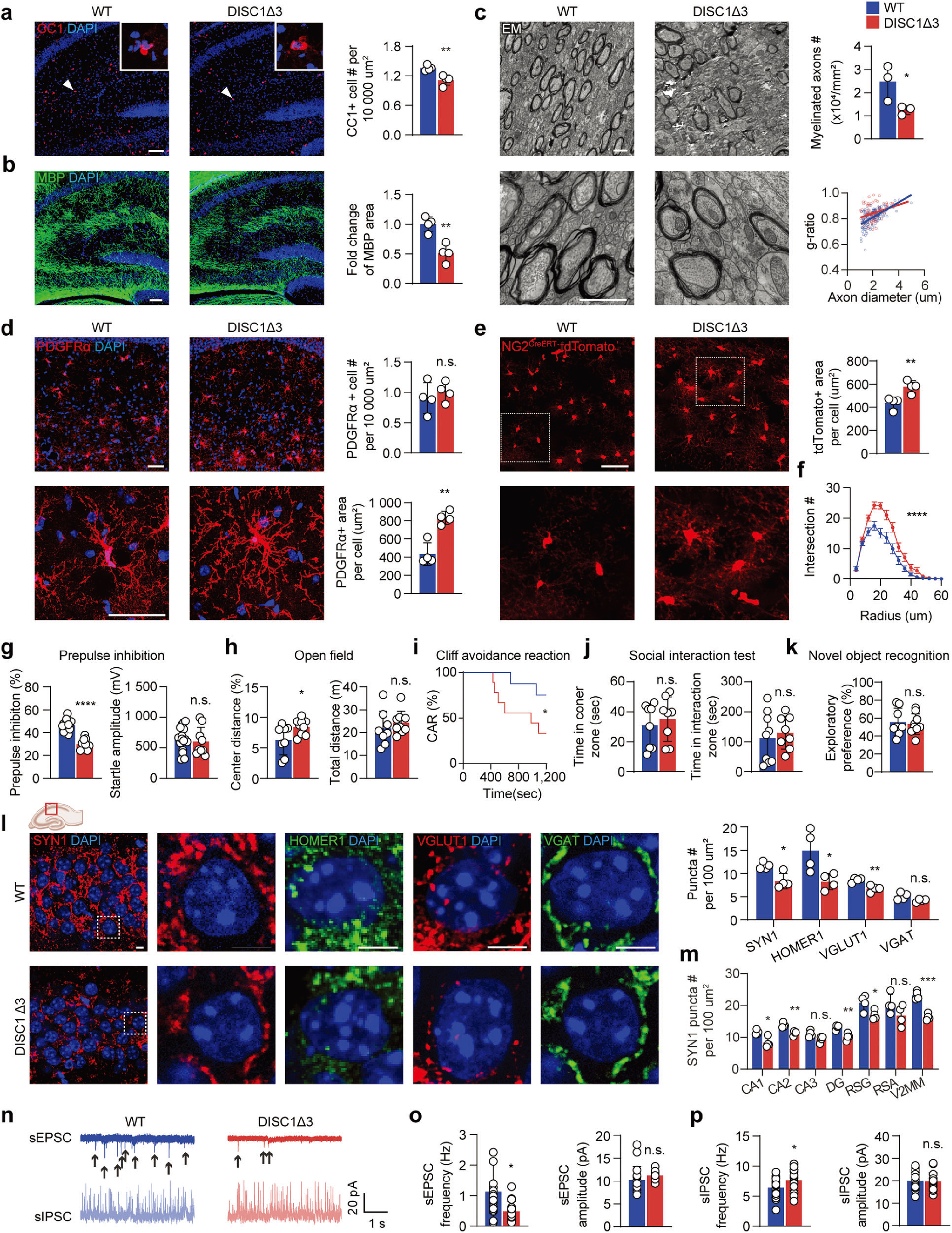
图2 DISC1-Δ3模型鼠模拟精神分裂症样表型
DISC1-Δ3模型鼠中OPCs异常参与突触形成缺陷及精神分裂症
随后,研究者分析了过度肥大的OPCs与精神分裂症患者髓鞘丢失的关系,通过他莫昔芬诱导DISC1-Δ3鼠在不同周龄发生OPCs中DISC1外显子3缺失,发现OPCs中DISC1外显子3缺失足以诱导突触功能障碍和精神分裂症样行为(图3a-f)。 接下来,研究者构建OL- DISC1-Δ3鼠(特异性在成熟少突胶质细胞中增强DISC1-Δ3表达)作进一步验证,发现特异性在P21小鼠海马OLs中增强DISC1-Δ3表达并未引起类似精神分裂症的病理变化(图3g-j)。同时,体外实验也验证了DISC1-Δ3 OPCs对神经元的直接影响(图3k-m)。 这些结果提示了,证明DISC1-Δ3小鼠中的突触形成缺陷与精神分裂症样表型是OPC本身的异常导致,而非髓鞘形成缺陷介导。
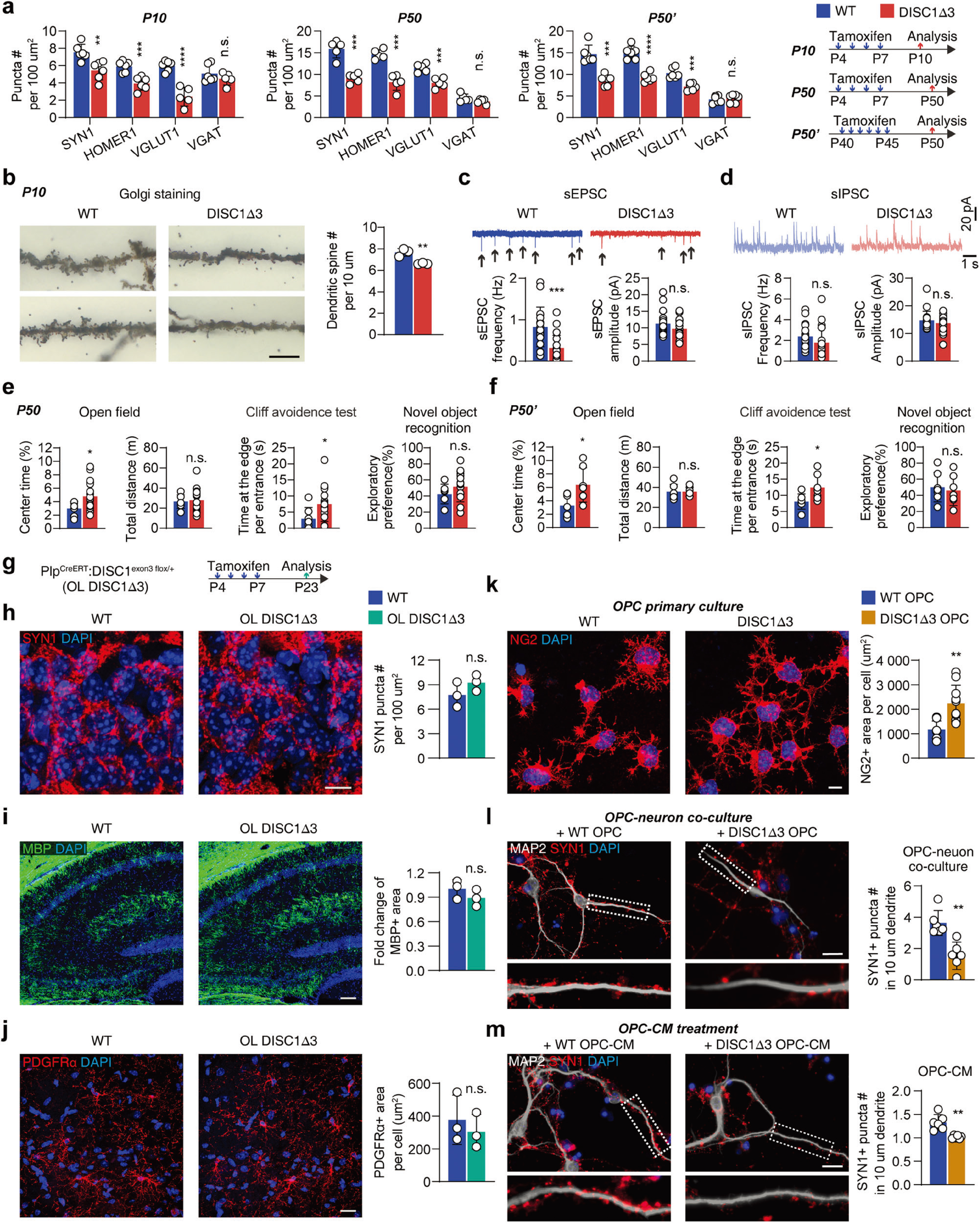
图3 DISC1-Δ3小鼠中的突触形成缺陷与精神分裂症样表型是OPC本身的异常导致,而非髓鞘形成缺陷介导
OPCs参与DISC1-Δ3模型鼠精神分裂症发生的分子机制
为验证其分子机制,研究者对急性分离的OPC进行RNA测序,发现在DISC1-Δ3 OPCs中Wnt/β-catenin信号通路过度激活(图4a,b),这是由于DISC1-Δ3通过Girdin-Akt通路间接抑制GSK3β活性,进而导致Wnt/β-catenin信号通路增加(图4a-d)。此外,基于临床样本,研究者发现精神分裂症患者海马区OPCs Wnt下游基因RNF43表达显著上调,这也印证了精神分裂症中少突胶质细胞前体细胞Wnt/β-catenin信号通路异常激活(图4e)。 接下来,研究者借助RNA-seq差异表达分析及分子生物学技术,在精神分裂症患者和DISC1-Δ3小鼠海马组织中发现Wif1表达显著增加(图4f-j)。并借助体外实验发现,Wnt/β-catenin过度激活的OPC通过Wif1抑制神经元中非经典Wnt通路,干扰突触形成(图4k,l)。
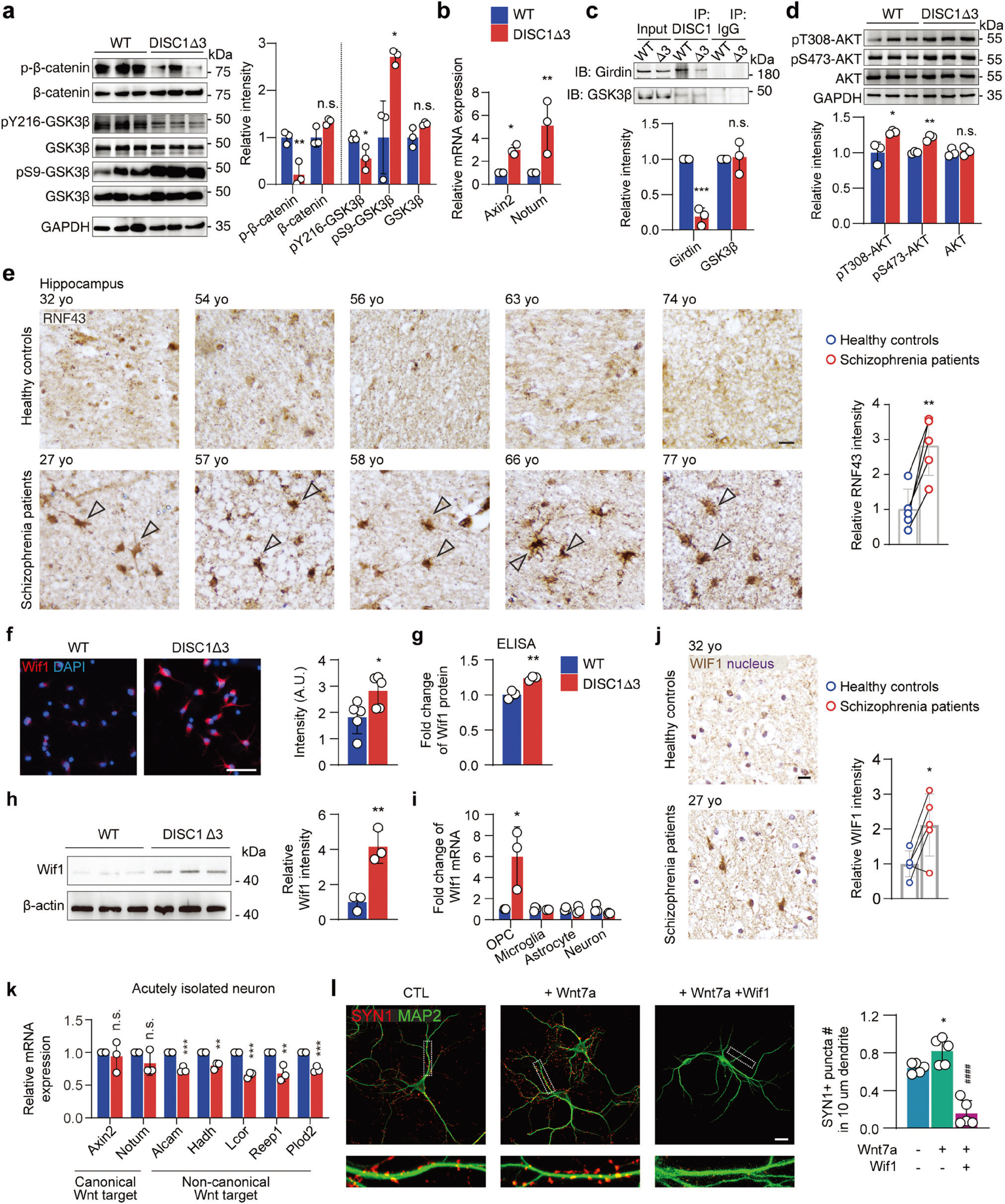
图4 DISC1-Δ3 OPCs中异常的Wnt/β-catenin异常激活
最后,研究者向P10 DISC1-Δ3鼠海马CA1注射逆转录病毒载体(特异性感染分裂期细胞)携带Wif1 shRNA(ROV-U6-shRNA(Wif1)-EF1A(S)-EGFP-3Flag)以特异性下调少突胶质细胞前体细胞中Wif1表达,发现增加了突触发生(图5a,b)。同样地,特异性敲除DISC1-Δ3鼠OPCs中Wif1,亦增强了海马兴奋性突触形成,并改善了精神分裂症样相关行为缺陷(图6c-i)。这些结果提示了,DISC1-Δ3鼠OPCs中Wnt信号通路异常激活通过调控Wnt抑制剂—Wif1表达量异常增加从而破坏突触形成,并启动精神分裂症的发病机制,下调OPCs中Wif1的表达可恢复DISC1-Δ3鼠突触形成,改善神经功能。
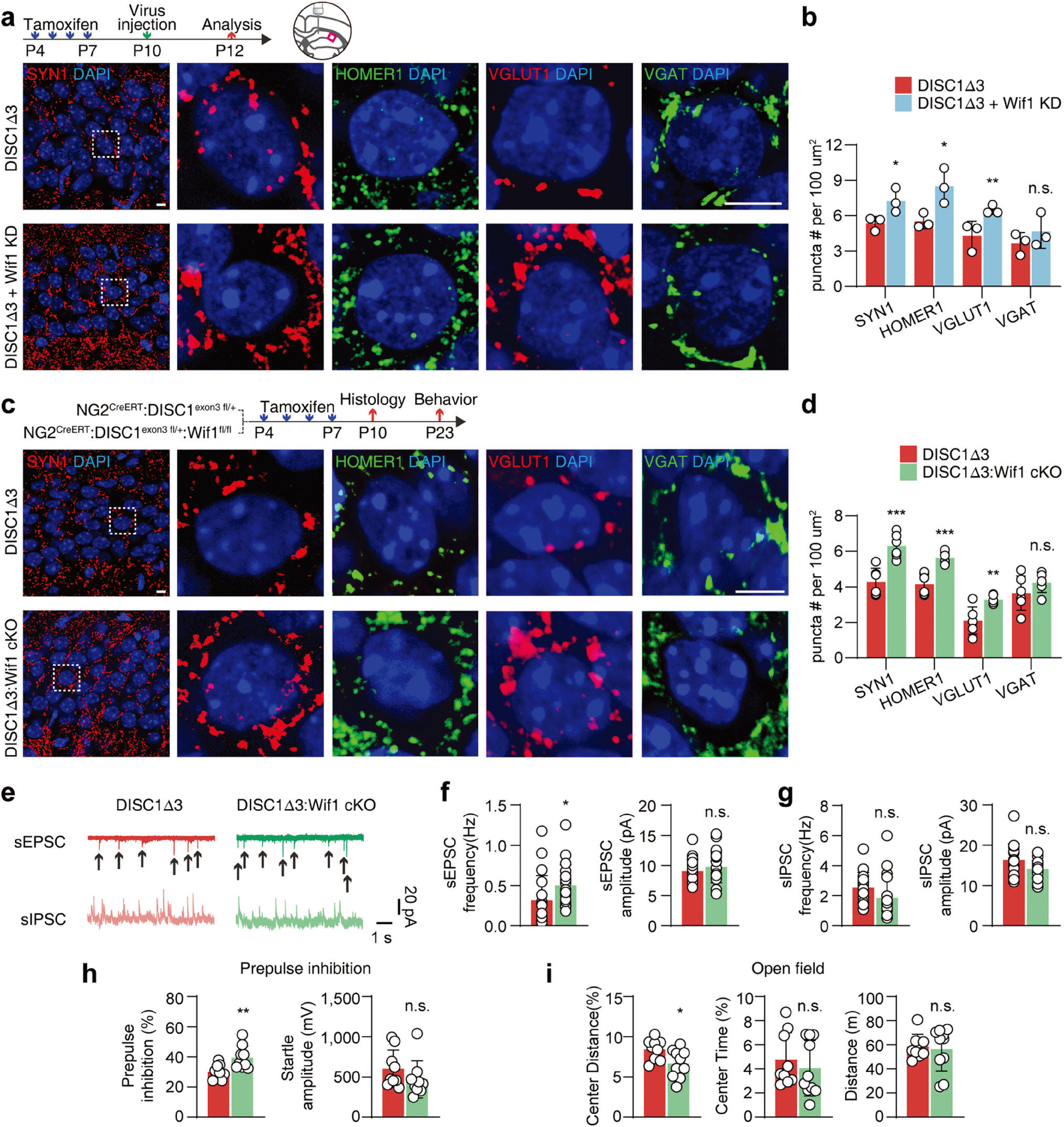
图5 下调OPCs中Wif1的表达可改善DISC1-Δ3鼠突触形成缺陷和行为障碍
结论
本文基于临床样本率先发现精神分裂症患者少突胶质细胞前体细胞(OPCs)形态异常,推测其可作为早期精神分裂症发病的病理性特征。随后,通过构建DISC1-Δ3鼠模拟精神分裂症表型,并借助RNA测序、行为学、病毒载体介导的基因功能丢失技术、分子生物学等多种技术手段发现,DISC1-Δ3 OPCs中Wnt/β-catenin的过度激活与下游Wif1异常高表达,并通过Wif1抑制神经元中非经典Wnt通路,干扰突触形成,而调控Wif1表达量可改善突触形成障碍和精神分裂症相关行为缺陷。该研究找到一个临床干预精神分裂症的分子靶点—Wif1,为精神分裂症的治疗提供了新的理论基础。 陆军军医大学博士生庾光丹与中山大学附属第七医院助理研究员苏一洵为本文共同第一作者。曼切斯特大学Alexei Verkhratsky教授、陆军军医大学肖岚教授与牛建钦教授(Lead Contact)为本文共同通讯作者。
