编者按:
遗传类疾病是主要疾病类型之一,儿童住院类型中高达70%是遗传类疾病,成人住院类型中也有10%是因为遗传类疾病。许多最常见的遗传性疾病,包括地中海贫血症、囊性纤维化和镰状细胞病,目前能做的也只有支持性护理,仍然缺乏有效的治疗方案。人类基因组计划其中一个预期目标,是通过鉴定导致遗传类疾病的基因,并采用基因修复的方式来促进对疾病的治疗,而实现这一目标最重要的途径是发展治疗性基因的在体递送方案。体内基因置换治疗遗传性疾病是现代医学中最引人注目的概念之一。腺相关病毒(AAV)载体已被广泛用于这一目的,并已证明在一系列动物模型中的治疗效果。成功的转化医学研究起步较慢,但替换基因在治疗水平上的长期表达现已被证实在遗传性视网膜疾病和血友病B患者中取得了成功。近期令人振奋的结果也为许多其他疾病的治疗带来了希望。
基因治疗的临床试验开始于20多年前,在过去几十年中,对于人类遗传性疾病的基因治疗的成功案例稳步递增。在遗传性疾病的基因治疗策略中,普遍认可的方案是两种病毒载体,即体外基因递送到造血细胞和其他干细胞的慢病毒(LV)载体,以及在体将病毒递送到病变组织的腺相关病毒(AAV)载体。临床研究发现,这两种病毒载体的毒性特征完全不同,LV载体的主要安全问题是插入突变相关的风险,而AAV载体主要的安全问题是影响病毒发挥作用的免疫反应。
小编在这里给大家推荐Mingozzi F和High KA发表在《Nature Reviews Genetics》题为“Therapeutic in vivo gene transfer for genetic disease using AAV:progress and challenges”的综述文章,本文作者重点介绍了利用AAV在体进行体内基因递送治疗遗传性疾病的最新进展。迄今为止体内基因递送最有临床转化潜力的是AAV载体,AAV基因治疗的前景和挑战很大程度上取决于靶组织和特定疾病 。AAV载体体内基因递送面临的最常见的挑战是组织特异的免疫反应,因此本综述是围绕AAV载体靶向特定组织(如:视网膜、中枢神经系统、肝脏和骨骼肌等)相关的进展和挑战进行论述。
表一. AAV载体体内递送的临床试验进展
AADC:芳香族L-氨基酸脱羧酶;AAV:腺相关病毒;CFTR:囊性纤维化跨膜转运调节因子;CLN2/TPP1:三肽基肽酶1;GAA:酸性α-葡萄糖苷酶;GAD:谷氨酸脱羧酶;LPL:脂蛋白脂肪酶;NA:未提供;RPE65:视网膜色素上皮特异蛋白65KDa;SERCA2a:肌浆网钙ATP酶2a;sFLT01:血管内皮生长因子天然受体的一部分;TNFR-Fc:肿瘤坏死因子受体-免疫球蛋白Fc片段融合蛋白。
一、基因递送至视网膜
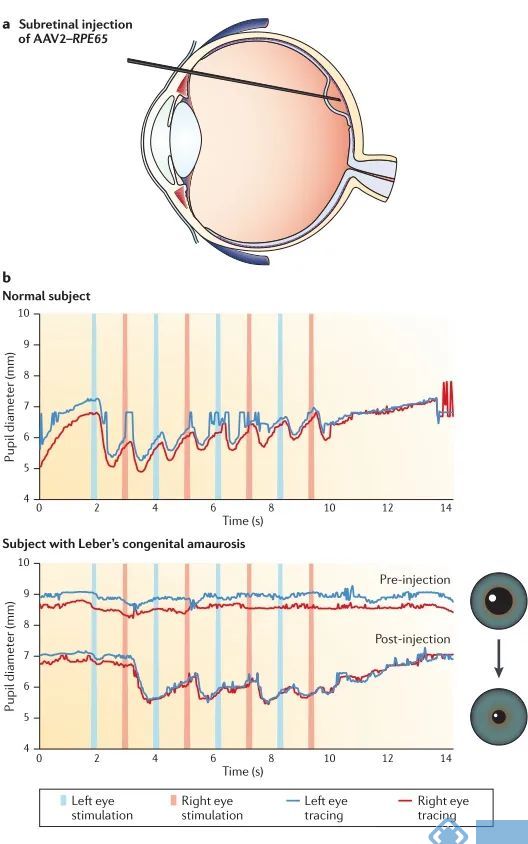
使用AAV载体进行临床体内基因递送最引起广泛关注的是视网膜退行性疾病—Leber先天性黑蒙症(LCA)。LCA是由于常染色体14种基因之一或者组合突变引起的。在RPE65(编码视网膜色素上皮特异65 kDa蛋白的基因)突变导致的Leber先天性黑蒙症小鼠模型或者犬类模型中,通过视网膜下注射表达RPE65的AAV载体,均实现了良好的治疗效果。基于这个振奋人心的消息,在2007年开展了利用AAV载体在体递送RPE65基因以治疗LCA的临床试验。在临床治疗的25名患者中,均没有明显的不良反应,并且在三年时间内,患者的视觉功能的心理物理测量(视力和视野)、客观测量(如瞳孔光反应或全场感光度)和功能测量(如在昏暗的光线下穿越障碍的能力)数据均有持续的明显改善。目前正在进行和计划进行的临床和基础试验可能会改变眼科实践的研究方向,例如需要对遗传性视网膜退行性疾病患者进行基因分型、对外科医生视网膜下注射方面的专业知识和技能有更高要求。
但我们必须认识到遗传疾病的一个关键问题:实施基因治疗的疾病阶段对临床疗效的影响。例如在基因治疗血友病时,到某个阶段之后,即使凝血因子恢复到正常水平,复发性血栓造成的关节进行性损伤是永久性不可逆的。由于患病人群规模小,尽管有令人信服的临床前数据,RPE65基因治疗方案并没有吸引到商业资金进行临床试验。然而,这种疾病的概念证明为一系列更常见的遗传性视网膜退行性疾病的临床试验奠定了基础,例如Leber遗传性视神经病变、脉络膜血症、X连锁视网膜劈裂(NCT00055029),与年龄相关的视网膜黄斑变性(NCT01024998)等。
图1. AAV治疗视网膜退行性疾病—Leber先天性黑蒙症
二、基因递送至肝脏
肝脏是机体主要的合成器官之一,是在体基因递送研究的理想组织。目前基础研究的体内基因递送到肝脏可治疗各种血浆蛋白缺乏症和代谢紊乱,如鸟氨酸氨甲酰基转移酶(OTC)缺乏症,甲基丙二酸血症,家族性高胆固醇血症、溶酶体贮积症等。在临床领域的成功一直比较缓慢,但最近的研究表明,朝着长期表达的目标取得的进展正在发生。
表二. AAV体内基因递送至肝脏治疗动物疾病模型
AAV:腺相关病毒;AGA:α-半乳糖苷酶A;CBS:胱硫醚-β-合成酶;cG6Pase:葡萄糖-6-磷酸酶;GC:葡萄糖脑苷脂酶;GSD-Ia:糖原贮积病Ia型;GUSB:β-葡萄糖醛酸糖苷酶:Hfe:血色病;IDUA:艾杜糖醛酸酶;LDL:低密度脂蛋白;LDLR:LDL受体;MPS:粘多糖贮积症;OTC:鸟氨酸氨甲酰基转移酶;PCCA:丙酰辅酶A羧化酶α多肽;PKU:苯丙酮尿症;UGT1A1:UDP(尿苷二磷酸)-葡糖醛酸基转移酶1家族多肽A1。
1.AAV肝脏注射治疗血友病B
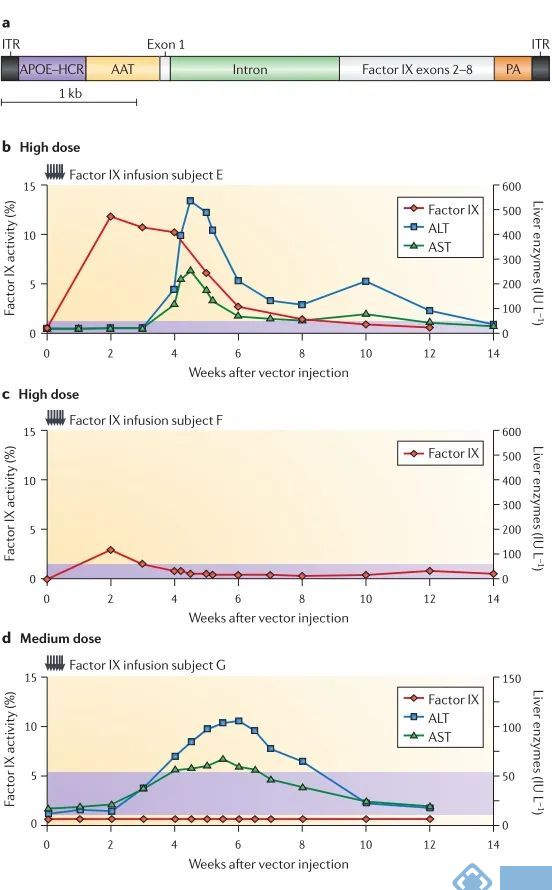
血友病B是一种由编码凝血因子IX基因突变引起的遗传性疾病,目前治疗这种疾病的方式是静脉输注凝血因子,但由于这些药物相当昂贵,世界上只有大约20%的血友病患者能负担得起。而AAV肝脏注射是治疗严重血友病B的一个有转化前景的治疗方案。最初的临床前AAV治疗方案是基于两个血友病B动物模型,由于其良好的治疗效果引起临床的重视,随后在临床试验中,对8名患有严重血友病B的受试者骨骼肌注射携带编码凝血因子IX基因的AAV2载体,取得一定疗效。但该载体要想通过肝动脉给药,有几个必须要考虑的问题:首先,AAV载体以前从未被注射到人类受试者的肝脏中,且基因治疗试验中唯一的死亡病例是腺病毒载体被注射到OTC缺乏症受试者的肝脏。同时在一名受试者的治疗过程中发现,凝血因子IX水平的升高只持续了大约10周,并没有达到长期治疗的目的。
图2. AAV注射到肝脏治疗面临的障碍
目前认为在体感染时,AAV载体基因组从衣壳中释放出来进入细胞内。产生的衣壳衍生肽被加载到主要组织相容性复合体I(MHCI)上,并出现在感染细胞的表面。此类肝细胞可能被特异性CD8+T细胞识别,进而清除感染的细胞,导致疗效的中断。
图3. 血友病B的IX因子功能缺陷治疗障碍
2.AAV肝脏注射的未来前景
如何在肝脏注射试验中避免检测到的免疫反应是基因治疗效果稳定性的关键。目前可以采用AAV载体与短期免疫抑制剂联合用药,试图阻止衣壳特异性T细胞反应的激活,避免感染的肝细胞被免疫清除。此外,设计出更有效率的病毒表达载体是一个更好的治疗策略,因为载体的剂量较低,在保证治疗基因凝血因子IX表达的同时,又可避免引起免疫反应。
三、基因递送至中枢神经系统(CNS)
对于遗传性退行性疾病的体内基因递送到中枢神经系统的早期临床研究并不多,目前也没有像视网膜退行性疾病那样取得明显成功的案例。该方案目前有两个明显的局限性,第一是局部脑区递送和全脑区递送的问题,虽然在帕金森氏病等少数疾病发现局部递送可以起到治疗作用,但对于大多数神经退行性疾病,需要将AAV载体向中枢神经系统进行全脑区递送。第二个问题是如何透过血脑屏障(BBB)的问题,这是所有向中枢神经系统提供治疗的药物都会面临的障碍。目前针对以上两个主要问题,神经科学家们进行了一系列的探索实验。
1.工程化的病毒载体
确定用于CNS基因转移的最佳AAV载体血清型一直以来是研究热点。AAV1介导的CLN2(编码三肽基肽酶1,也称TPP1)基因递送在晚期神经元蜡样脂褐质沉积症(NCL)幼鼠模型中显示出良好的治疗结果。通过工程化修饰AAV载体衣壳,改变其趋向性也是该领域的研究热点。科学家通过鉴定脑疾病模型中内皮细胞独特的多肽,并将其插入载体衣壳中,可介导治疗性基因载体透过BBB递送到整个大脑。
2.递送技术
除了工程化AAV病毒载体之外,增强病毒的递送技术也十分重要。对流增强递送技术,即利用流体静压强将药物注射到血管周围进一步在脑实质中扩散的技术,已经成功地运用在非人灵长类动物递送AAV载体。将AAV载体注入脑室使得病毒载体能在脑脊液中循环,也能实现更广泛的中枢神经系统的感染。而使用立体定位注射技术将病毒注射到局部脑区中,可实现对中枢神经系统特定脑区的感染。近期已有通过立体定向注射技术,将病毒注射到帕金森氏病患者的纹状体相关的临床试验。
3.递送到CNS的其他考虑因素
关于将治疗基因递送到中枢神经系统,还有其他需要考虑的因素。例如,要把握这些中枢系统的遗传性疾病的最佳治疗窗口期,一般需要在中枢神经系统发生不可逆转的变化之前进行治疗干预。
四、基因递送至骨骼肌
体内基因递送至骨骼肌可治疗神经肌肉和新陈代谢相关遗传性疾病,例如α1抗胰蛋白酶缺乏症、脂蛋白脂肪酶缺乏症。通过肌肉注射将AAV载体注射到骨骼肌有许多优点,例如递送过程简单、病毒在靶组织外的扩散相对较少、对AAV载体的体液免疫效果较弱等。
1.肌肉注射AAV载体
第一项肌肉注射AAV载体的临床研究是1999年对治疗血友病B的治疗。在治疗过程中,8名受试者的肌肉组织均检测到转导靶基因凝血因子IX的表达,体现了该治疗方案的安全性和良好的耐受性。但是在体液循环中,检测到表达凝血因子IX的量低于临床的治疗剂量。这可能与体内免疫系统产生的中和抗体有关。在另一项以AAV1载体进行肌肉注射治疗α1抗胰蛋白酶缺乏症的临床过程中也发现,病毒表达的蛋白在循环里检测的剂量远远低于治疗使用的蛋白剂量。因此,在进行肌肉注射AAV载体进行治疗时,需要更有效的病毒表达载体和更好的免疫逃逸作用。
2.大范围肌肉组织进行基因递送
肌肉组织的基因递送治疗的一个主要目标是肌营养不良症。根据静脉压力可以可逆地改变毛细血管微静脉中相邻内皮细胞的接触强度,从而导致病毒载体从循环渗出到肌肉组织的原理,可在肌肉组织进行安全有效地病毒感染。目前这种方法在贝克氏肌营养不良症患者身上进行了初步的临床试验。
3.病毒衣壳引起的免疫反应
将治疗基因表达到肌肉组织中面临最重要的挑战是避免病毒衣壳激发免疫反应导致的负面影响。目前发现针对AAV衣壳,T细胞具有较高的灵敏度,在较高的病毒载体剂量下,受试者的T细胞数量显著增加。另外高剂量的载体时,发现在外周血很早就出现了衣壳特异性T细胞的激活。衣壳特异性T细胞的激活可能受到以下因素的影响,包括:转导靶基因自身的免疫调节特性;靶组织中主要组织相容性复合体(MHC)I类的表达水平;靶组织中的炎症;反应性T细胞的凋亡;以及受试者的人类白细胞抗原(HLA)等位基因引起的变异。在未来AAV载体注射的临床研究中,对病毒衣壳免疫反应的临床监测将是解决上述问题的关键。
五、展望
通过病毒载体的基因递送是迄今为止最有前景和最复杂的治疗方案,在基因和蛋白层面对疾病的预后发挥重要作用。尽管目前基因治疗策略在临床上已经取得了初步的治疗效果。但是由于解剖学和免疫学上的一些问题,体内基因递送仍然存在许多组织特异性的障碍。并且在使用AAV进行临床治疗的过程中,必须要明确疾病干预的阶段对于治疗效果的重要性,必须要把握AAV基因传递的起效剂量和持续时间,必须解决AAV载体插入引起的突变风险并保障其安全性。总而言之,只要充分发挥AAV基因递送疗法的优势,优化病毒的表达效率和免疫反应,AAV载体的基因递送疗法将是解决一系列遗传性疾病最好的治疗选择。
扫码下载原文
我司可提供神经系统疾病模型构建及相关检测服务(更多服务及详情请咨询我们!)
免疫组化检测:GFAP,ChAT,TH,c-fos等
我司重磅推出环路示踪,光遗传,钙记录,膜片钳,电生理等动物实验服务!
公司相关业务:
神经环路示踪病毒载体、基因编辑(敲入、敲除、点突变、敲低)、基因过表达/干扰服务、行为学小鼠模型构建、干细胞诱导分化、整包服务等。