
发表期刊:Angewandte Chemie International Edition
影响因子:12.959
合作客户:中山大学
百趣生物提供服务:iTRAQ标记定量蛋白组(可点击了解产品详情)
01.研究简介
金属类药物顺铂是对抗肿瘤的一线武器。科学家们一直在致力于提高铂类药物的抗癌效果并减少其副作用。其中铂(IV)前药修饰的轴向配体可以与铂(II)药物协同的方式提高疗效,包括调节亲脂性和动力学,释放多种生物活性物质,抑制DNA修复途径等。缺氧和酸性微环境是实体瘤的主要特征,在促进肿瘤生长、血管生成和转移方面发挥着重要作用。缺氧和低酸碱度会影响大多数化疗药物的稳定性、渗透性和生物过程,从而降低其抗癌效果。因此,开发能够克服缺氧和调节微环境的新型铂类药物具有深远的临床意义和应用价值。
碳酸酐酶IX (CAIX)是一种跨膜蛋白,在发育中的侵袭性肿瘤组织中过度表达,负责调节细胞内外的pH平衡。抑制CAIX不仅是调节肿瘤组织特有的缺氧和酸性微环境的有效途径,还能干扰肿瘤代谢。
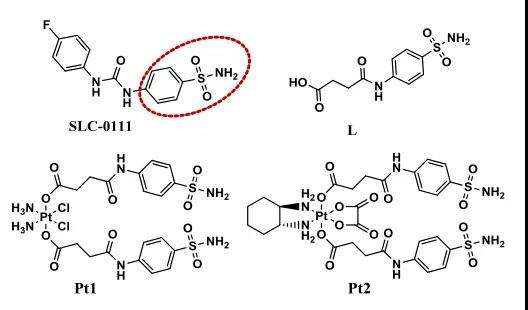
中山大学的毛宗万课题组在相关的研究工作中,对作为铂(IV)前体药物的轴向配体引入了CAIX抑制剂(CAIXplatin)(图1),旨在调节肿瘤微环境和代谢,以增强铂类药物对肿瘤的治疗效果。
02.设计优势
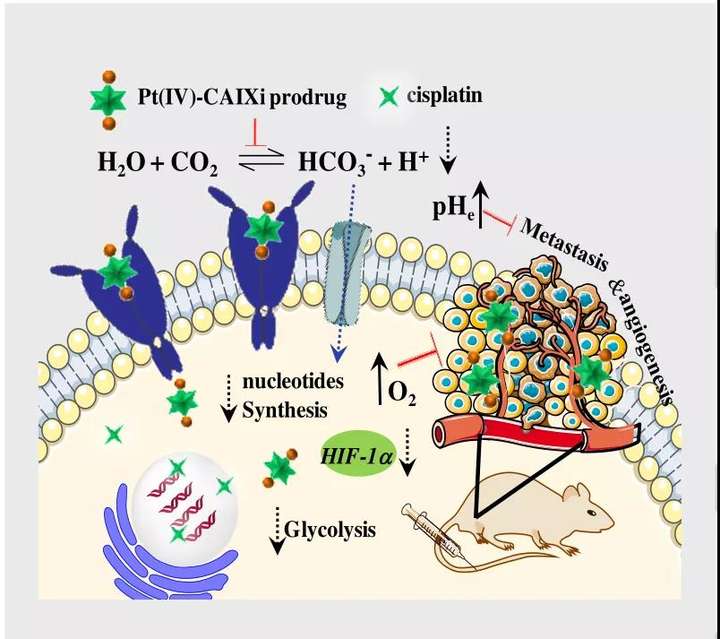
1. CAIXplatins可显著促进癌症特异性靶向,使得对正常细胞系具有极低的毒性(IC50 >100μM,72 h),并且在缺氧条件下癌症选择性指数(SI)比顺铂/奥沙利铂高70~90倍;
2. CAIXplatins对CAIX具有强亲和力和抑制活性,可以克服缺氧和酸性微环境,产生高效的抗转移和抗血管生成活性;
3. CAIXplatins还可以干扰负责能量供应和生物大分子合成的低氧癌细胞的代谢途径,显著增强低氧肿瘤的治疗效果。
03.研究结果
1. 以顺铂和奥沙利铂为核心的Pt1和Pt2的CAIXplatins开发
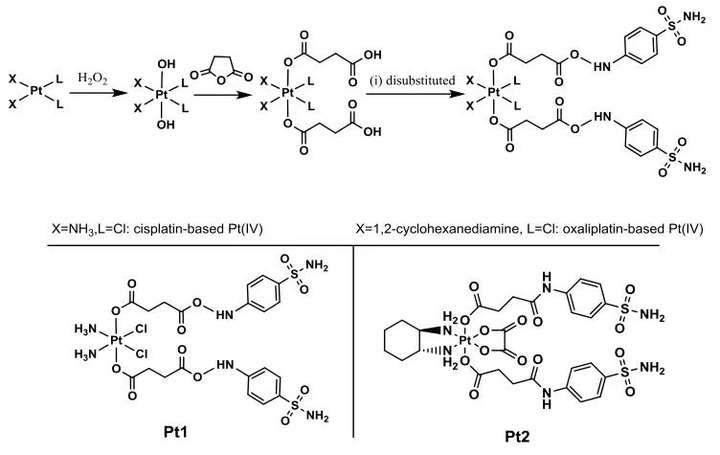
轴向配体L被设计为含有苯磺酰胺(CAIX抑制剂的常见活性部分),以顺铂和奥沙利铂为核心开发了Pt1和Pt2的CAIXplatins(图3)。其结构通过元素分析、电喷雾质谱、1H、13C、195Pt核磁共振和高效液相色谱进行表征。对Pt1和Pt2 的还原性研究中,发现Pt1 (8.576min)的HPLC信号随着对应于L (7.813min)轴向释放的峰的出现而降低,并且几乎所有Pt1在1小时内降低。表明铂(IV)化合物可以有效地减少铂(II)药物的释放,Pt2在血液循环中可能比Pt1更稳定。
2. 细胞毒性、抗转移和血管生成作用等药物有效性的指标检测
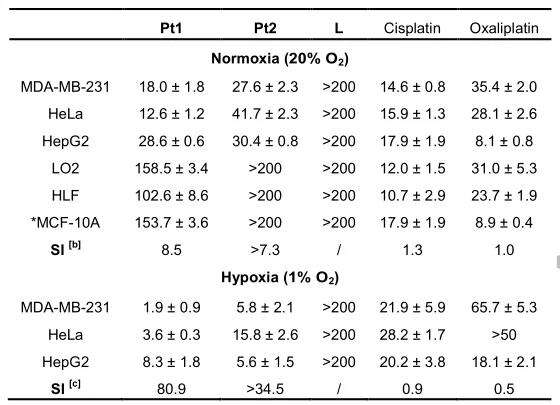
作者使用顺铂/奥沙利铂作为阳性对照,通过MTT法(72 h)评估了L、Pt1和Pt2对各种癌细胞系(三阴性乳腺癌MDA-MB-231、HeLa、HepG2)和正常细胞系的体外细胞毒性。在常氧(20% O2)条件下,Pt1和Pt2对癌细胞株均表现出中等细胞毒性,这与顺铂/奥沙利铂相似。然而,Pt1和Pt2对正常细胞系的细胞毒性极低(IC50 > 100μM),癌症选择性指数(SI)比顺铂/奥沙利铂高8倍(表1)。Pt1和Pt2的癌症选择性指数在缺氧时显著升高,比顺铂/奥沙利铂的SI高70~90倍。这些结果表明,Pt1和Pt2可以克服缺氧,从而选择性地杀死缺氧癌细胞。
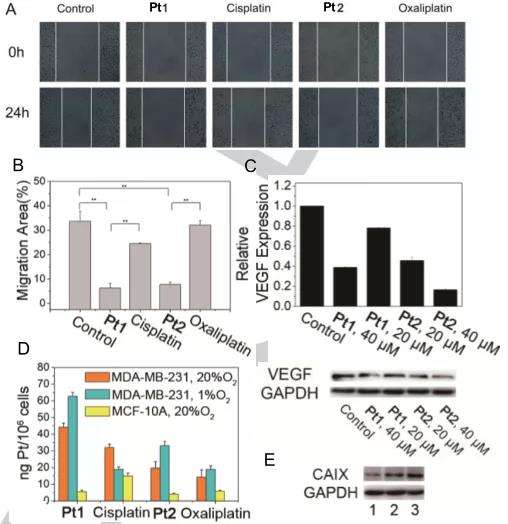
Pt1和Pt2在缺氧的MDA-MB-231细胞(1% O2)中的抗转移和抗血管生成作用相关的实验,如伤口愈合试验,图4A-B所示,使用Pt1和Pt2处理(5μM,24h)时,细胞迁移被显著抑制了81.2%和77.0%,而在相同条件下用顺铂和奥沙利铂处理仅抑制了27.1%和4.5%。这表明Pt1和Pt2具有显著的抗转移活性。同时,Western blotting (图4C)结果表面Pt1和Pt2能够以剂量依赖的方式显著降低缺氧的MDA-MB-231细胞(1% O2)中血管内皮生长因子的表达水平。
表1 受试化合物对癌细胞系和正常细胞系的细胞毒性
3. 在体外试剂盒和细胞水平上研究Pt1和Pt2对CAIX的抑制作用
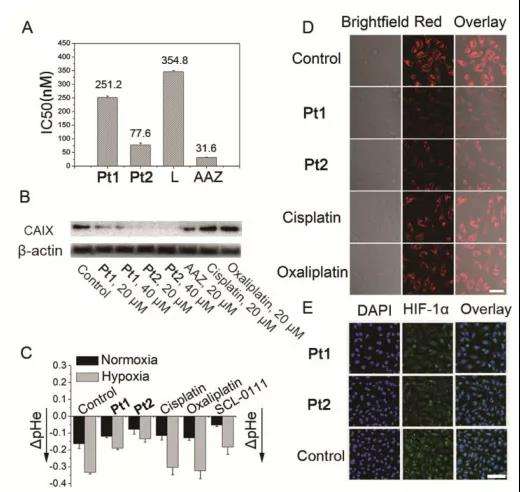
在体外试剂盒检测实验中,使用人CAIX作为酶源,4-NPA作为底物,Pt1和Pt2都可以有效地抑制CAIX活性(图5A)。在缺氧的MDA-MB-231细胞(1% O2)中,CAIX的表达不受顺铂/奥沙利铂的影响,但被Pt1和Pt2以剂量依赖性方式显著抑制,并且Pt2的抑制效果优于Pt1(图5B)。
为了研究CAIX在维持缺氧和酸性微环境中的作用,作者对MDA-MB-231细胞的胞外pH值和O2含量进行了检测。如图5D-E所示,低氧细胞(1% O2)在Pt1和Pt2 (10 μM)处理后,RDDP红色荧光基本上被淬灭,表明细胞O2浓度增加,同时发现HIF-α表达水平降低。细胞O2含量不受顺铂或奥沙利铂的影响,Pt1和Pt2主要通过CAIXi的作用而不是铂(II)的作用来克服缺氧。在缺氧(1% O2)条件下培养的MDA-MB-231 细胞pHe值比常氧(20% O2)条件下低,表明缺氧和癌细胞的细胞外酸化之间存在正相关(图5C)。以上这些结果表明,Pt1和Pt2能有效结合CAIX并抑制其活性,从而克服缺氧并减弱缺氧癌细胞的细胞外酸化,这有助于提高其抗转移和抗血管生成活性。
4. 应用iTRAQ标记定量蛋白组技术(由百趣生物提供)研究Pt1/Pt2影响蛋白表达量的变化
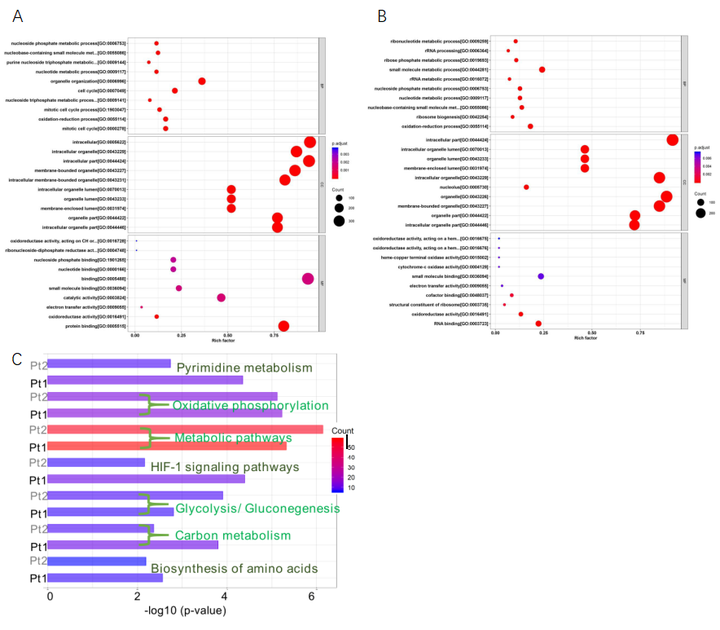
从Pt1和Pt2细胞处理组中筛选出差异表达的蛋白质。在Pt1处理组中有174个上调和112个下调的蛋白质,而在Pt2处理组中下调蛋白为102个,下调蛋白有221个。GO分析(图6A)结果表明这些差异表白主要参与氧化还原和生物分子代谢过程。EGCC途径分析(图6C)发现在Pt1和Pt2处理的细胞中有几个重要的代谢途径受到扰动。如糖酵解/糖异生、碳代谢和缺氧诱导因子1信号通路都存在糖酵解相关关键蛋白的下调,导致乳酸和ATP的减少。在Pt1和Pt2处理的低氧癌细胞中,氧化磷酸化途径也被抑制。此外,嘧啶代谢和氨基酸生物合成也受到严重影响,导致生物合成原料严重短缺。这些蛋白质组学分析结果表明Pt1和Pt2不仅能调节缺氧和酸性微环境,而且能显著影响缺氧癌细胞的代谢功能,特别是能量供应和生物大分子合成的相关功能。
5. 动物实验:评估CAIXplatin体内抗肿瘤效果
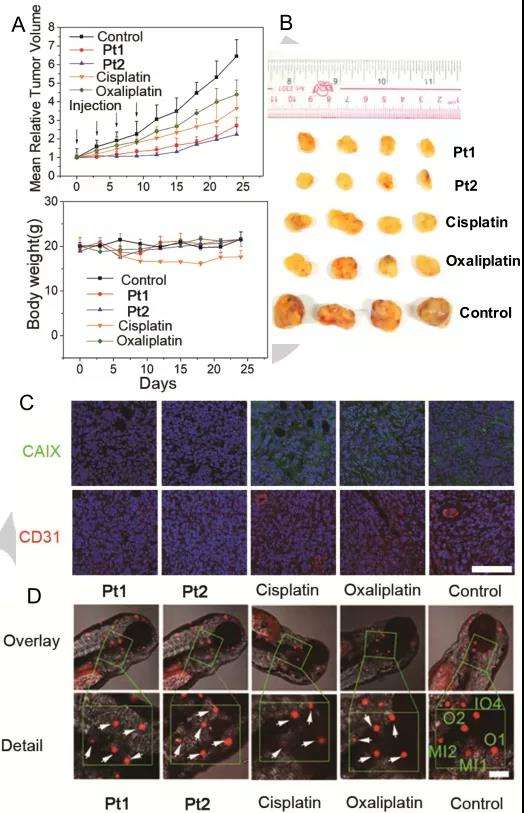
选择具有80mm3体积MDA-MB-231肿瘤的BALB/c裸鼠进行体内抗肿瘤效果研究。他们被随机分成5组(n = 4)进行尾静脉注射(i.v. 120μL, 5 mg kg-1)赋形剂和各种铂类药物。每3天测量一次肿瘤体积和小鼠重量,24天后处死所有小鼠并收集各组中的肿瘤(图7A-B)。发现在连续四次注射后,与对照组相比,Pt1和Pt2组可分别抑制肿瘤生长57.9%和65.3%,而顺铂和奥沙利铂组仅抑制肿瘤生长43.4%和32.0%,因此体内抗癌效果为Pt2 > Pt1 >顺铂>奥沙利铂。在注射各种铂类药物(静脉注射120μL,5 mg kg-1)24h后,使用免疫荧光测定法测量肿瘤组织中CAIX和CD31(血管生成标记物)的表达水平。与对照组相比,CAIX(绿色)和CD31(红色)的荧光不受顺铂或奥沙利铂的影响,但在Pt1和Pt2处理后基本上被抑制(图7C)。结合前面的实验,Pt1和Pt2已被证明具有显著的抗肿瘤效果和抗血管生成活性。
04.文章小结
作者设计了CAIX靶向铂(IV)前药Pt1和Pt2并对其抗肿瘤效果进行评价,它们不仅能有效地杀死低氧癌细胞,具有比顺铂/奥沙利铂高70~90倍的癌症选择性指数,而且能重塑肿瘤微环境和代谢,从而有效地抑制肿瘤细胞增殖、转移和血管生成,体内研究进一步证明,与顺铂/奥沙利铂相比,Pt1和Pt2对MDA-MB-231肿瘤具有更好的抗癌效果,同时极大地消除了铂类药物的副作用,如肝毒性、肾毒性和耳毒性。因此,本研究提出CAIX靶向介导的微环境和代谢调节可作为克服铂类药物在治疗低氧和侵袭性肿瘤中的非选择性、低治疗效率和严重副作用的新方法。
文献原文下载
链接:https://pan.baidu.com/s/1E-pkwUpzUZ_0XISk5uCT8A
提取码:54vo
