哺乳动物的胃肠道拥有一个由多种微生物组成的群落,包括细菌、古细菌、真菌和病毒。在日常中,细菌的生存、复制会带来很多终产物,例如代谢产物和细菌的胞壁碎片等,这些产物与宿主的代谢过程密切相关。除影响代谢外,肠道微生物群还会影响免疫系统和中枢系统神经系统,越来越多的研究证明该系统已成为影响脑发育的关键调节因素,以及影响压力和焦虑状态的因素,且这种影响通常存在性别差异。研究表明,破坏肠道微生物群与大脑的相互作用关系,有潜在导致神经发育相关、精神疾病相关的可能。

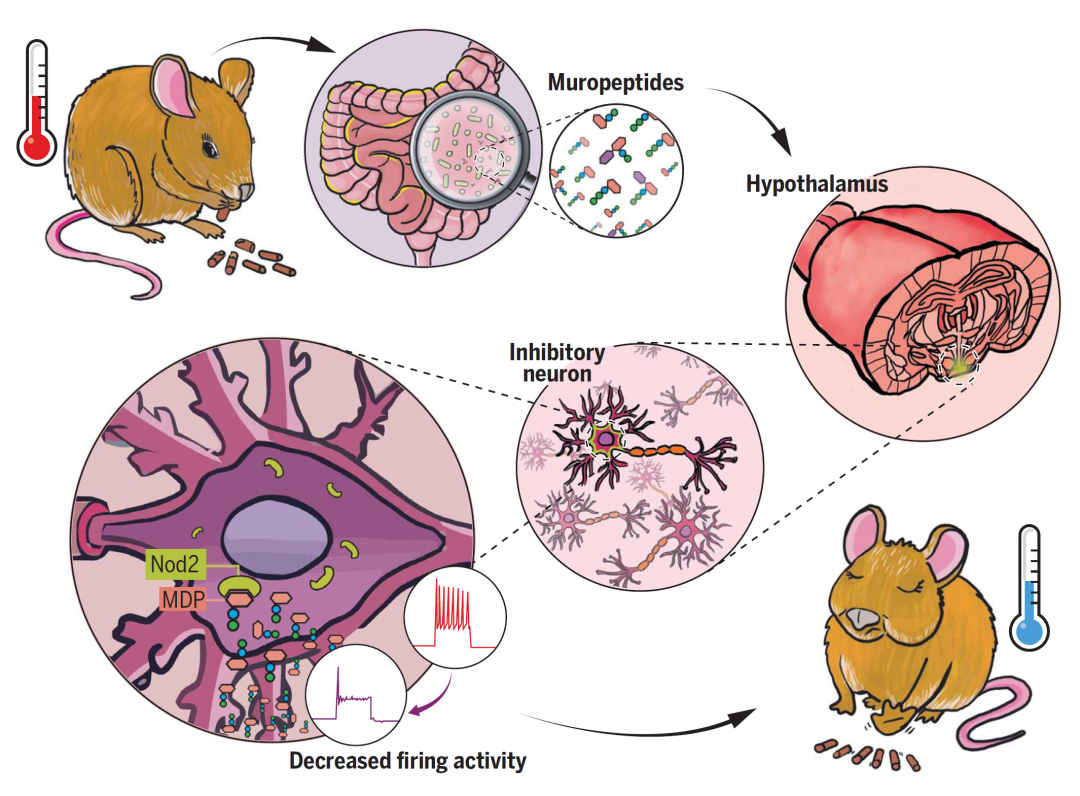
2022年4月15日,法国巴斯德研究所、国家健康与医学研究院(Inserm)和国家科学研究中心(CNRS)的Gabanyi博士等人在Science杂志发表最近研究工作" Bacterial sensing via neuronal Nod2 regulates appetite and body temperature ",他们发现细菌的产物--细菌肽聚糖(peptidoglycans)能够直接抑制下丘脑中促进摄食的神经元活动,从而降低动物的食欲和体温,且这一过程主要影响雌性小鼠。
这一发现提示,生理状态下,肠道微生物群和大脑之间存在直接对话,微生物群可通过肽聚糖影响动物生理状态的维持,这一发现可能会为代谢紊乱疾病,如糖尿病、肥胖,带来新的治疗思路和疗法。
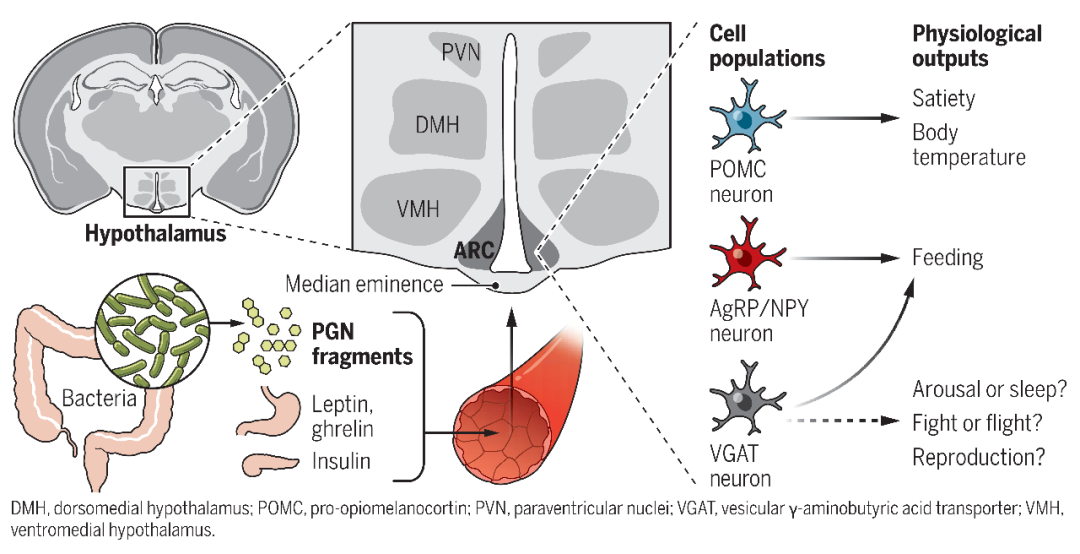
在过往的研究中,大量研究已提示肠道微生物群与脑的联系,其中细菌细胞壁的主要成分--肽聚糖(peptidoglycans,PGs)被认为是重要的影响动物代谢、免疫、动物行为的分子之一。同时研究发现PG的片段胞壁肽(muropeptide)确实存在于小鼠脑中,且能够影响神经元的活动和可塑性,因此研究人员推断胞壁肽可能是一个重要的肠道影响脑的信号。
研究表明,小鼠脑中的胞壁肽可被Nod样受体(Nod1和Nod2)识别,其中Nod1识别来源于革兰氏阴性菌胞壁酰三肽,Nod2负责识别胞壁酰二肽 (MDP)。其中,MDP是在所有细菌胞壁肽中存在的分子结构,且Nod2基因突变与双相情感障碍、精神分裂症、阿尔茨海默病、帕金森病、代谢紊乱等病理过程密切相关。
但是,Nod2介导的信号通路是否影响生理性稳态平衡并不清楚。因此,本文作者着重研究Nod2参与的生理性稳态调节过程。
作者首先借助Nod2-GFP转基因小鼠,绘制了Nod2在中枢神经系统的表达谱,免疫荧光染色的结果(图2)及Nod2基因mRNA原位杂交结果均显示,纹状体、丘脑和下丘脑神经元中Nod2的表达较多、皮层区域表达较少,而几乎所有脑区的小胶质细胞和内皮细胞均表达Nod2。
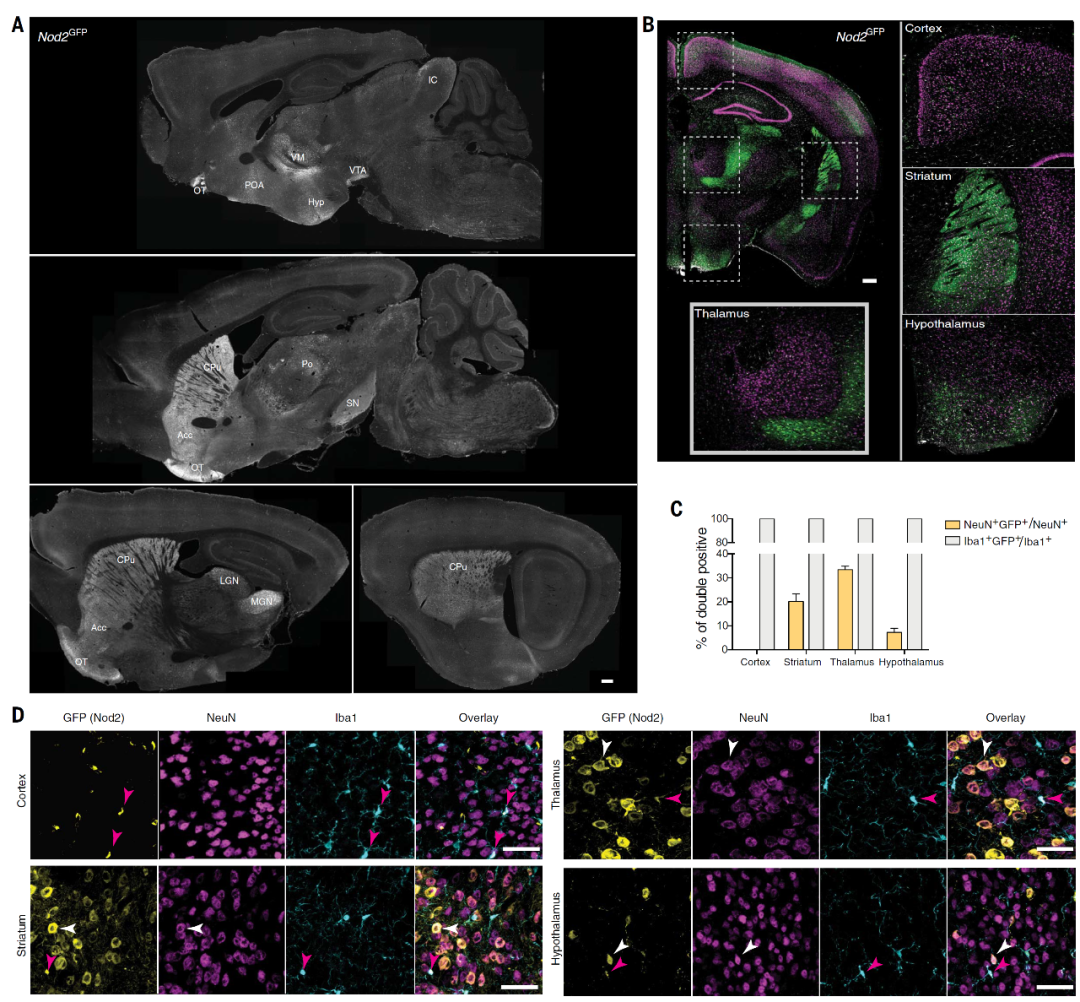

图3 脑能够直接摄取胞壁肽
接下来,作者研究特定神经元缺失Nod2受体对行为的影响。借助抑制性GABA能中间神经元或兴奋性CamKII阳性中间神经元的cre鼠(Vgat-cre和CamKIIa-cre)依赖的Nod2基因敲除鼠,作者发现只有雌性动物的Vgat神经元中Nod2基因被敲除,能导致显著的体重上升、食欲增加,影响中老年雌鼠(6个月之后)筑巢行为以及体温稳态调节(图4),此外,Vgat-Nod2基因敲除雌性小鼠最终易发展为糖尿病,寿命也明显减少。这些证据都表明了Nod2基因在GABA能中间神经元中的重要作用。
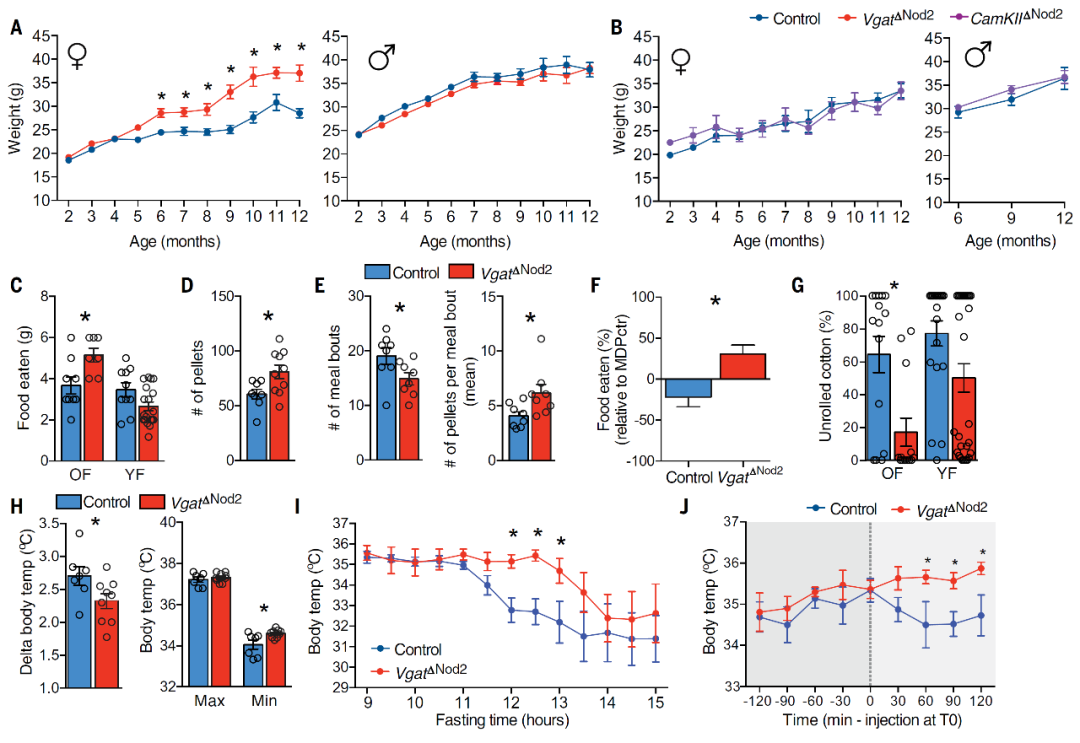
图4 GABA能中间神经元Nod2敲除影响中老年雌鼠摄食和体温稳态
随后的细胞活动性分析(Fos标记)发现,中老年雌鼠脑中弓状核(ARC)和背内侧核(DMH)活动对胞壁肽(MDP)更为敏感,而这两个脑区恰恰负责摄食和体温维持。结合前文发现的GABA能中间神经元在Nod2受体介导的上述过程中的作用,作者接下来着重研究ARC和DMH两个核团中GABA能中间神经元的作用。
借助Vagt-cre小鼠配合AAV9-FLEX-GCaMP系列病毒载体的定点注射,作者特异性在ARC脑区GABA能中间神经元(主要是NPY阳性神经元,负责促进摄食的神经元)表达GCaMP蛋白(GCaMP6f或GCaMP7f),用于观察该类神经元的活动,发现MDP的喂养能够显著抑制该类细胞的活动(图5),提示老年雌鼠的体重和体温紊乱与ARC脑区GABA能中间神经元活动密切相关。

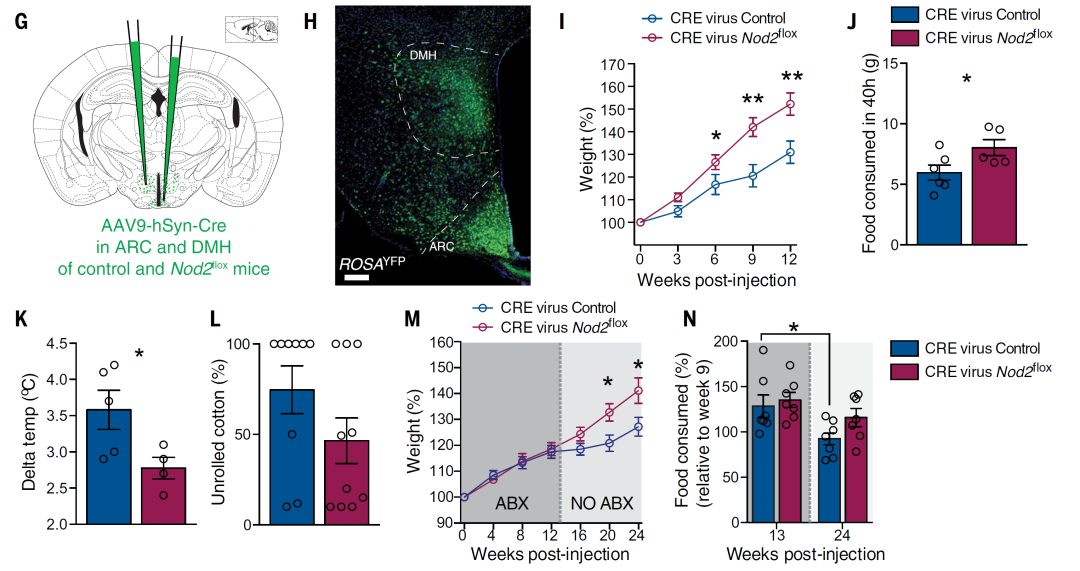
图6 下丘脑Nod2基因对体重和体温维持至关重要
综上所述,本文的多组实验为我们明确描绘了一组肠道微生物组代谢产物与脑中神经元的信号传递,微生物群释放的胞壁肽(Muropeptides)通过影响下丘脑中间神经元的活动,调控动物的摄食和体温维持。
和元生物可为研究者稳定提供文中大量使用的AAV9-hSyn-Cre、AAV9-FLEX-GCaMP6f、AAV9-FLEX-GCaMP7f等工具病毒载体,助力特定细胞的活动监测和基因操控。
参考文献:
1.I. Gabanyi et al., Science 376, 263 (2022).
2.Antoine Adamantidis, How the gut talks to the brain, Science
