编者按
肠道菌群是近年来中医药领域的研究热点,不仅与中医理论相契合,而且是中药口服发挥药效的重要靶点之一。基于肠道菌群的中药药理研究近年来也陆续刊登于核心期刊。
为了帮助广大研究者了解中医药相关肠道微生物的研究进展与方法,我们收集整理了近几年基于中药及肠靶轴研究的发表于GUT、Nature Communications、Theranostics等高水平期刊的论文。
【中医药与肠道菌群专辑】为大家精细解读重磅研究与进展。

【文献名称】Gut microbiota-derived inosine from dietary barley leaf supplementation attenuates colitis through PPARγ signaling activation
【杂志名】:Microbiome
【影响因子】:IF=11.607
【中药】:大麦叶
【疾病】:结肠炎
【样本类型】:葡聚糖硫酸钠 (DSS) 诱导的结肠炎小鼠模型
【技术方法】:非靶向代谢组学、转录组、16s
【关键菌群】:Lactobacillus
【是否菌群验证】:代谢物肌苷功能活性验证
研究背景
【中药背景】大麦叶(Barley leaf, BL)是大麦的幼草,是亚洲地区绿色功能性饮料的主要成分,也一种中草药成分。既往研究报道了大麦叶(BL)的抗氧化特性。此外,BL对肠道功能有潜在的健康促进作用。
【疾病和肠道菌群】炎症性肠病主要包含溃疡性结肠炎和克罗恩病。最近的研究表明,溃疡性结肠炎在发展中国家变得越来越频繁,已成为全球公共卫生挑战。溃疡性结肠炎的病因尚不完全清楚,已有研究表明结肠上皮PPARγ表达降低是导致肠道功能障碍和慢性炎症的重要因素。临床上PPARγ是5-氨基水杨酸、糖皮质激素等抗炎药物的重要靶点,然而大多以药物为基础的干预措施缺乏特异性,存在副作用。在肠道微生物研究方面,通过肠道微生物植物移植可以将结肠粘液层的不同性质转移给无菌小鼠。肠易激综合征患者的肠道菌群移植可能导致无菌小鼠肠道运动和屏障功能的改变,靶向肠道微生物群可能是预防和治疗结肠炎的有效途径。
本研究以小鼠结肠炎为模型,大麦叶(BL)显著减轻了疾病的严重程度和微生物群失调。肠道微生物衍生的嘌呤代谢产物肌苷通过腺苷2A受体(A2AR)-PPARγ信号介导BL对肠道功能的有益影响。该研究为BL保护结肠炎的潜在机制提供了新的见解,并突出了BL和肌苷在预防溃疡性结肠炎中的潜在应用。相关研究成果发表于顶级期刊《Microbiome》。
研究路线

主要研究结果
一、药效研究:大麦叶(BL)减轻葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎
小鼠经葡聚糖硫酸钠 (DSS) 诱导后,上皮细胞屏障会受到化学损害,导致肠道稳态的破坏和肠道微生物群的失调。对照组饲喂标准鼠粮(CD),BL组在标准鼠粮基础上添加2.5%大麦叶(BL)。
(1) 表型指标变化
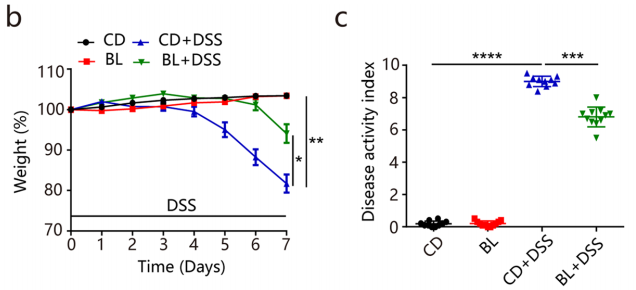
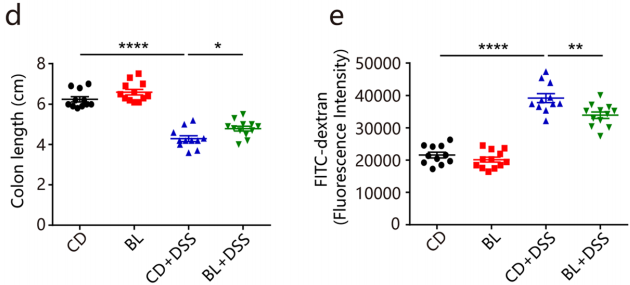
对照组和BL组小鼠在食物和水摄入量无差异,表明BL对饮食习惯没有影响。BL显著缓解DSS诱导的体重减轻、疾病指数(DAI)评分降低和结肠缩短,也显著保护了肠道通透性(图b-e)。
(2) 炎症因子改变
炎症因子是结肠炎发病的关键因素,BL显著提高小鼠血清IL-4和IL-10水平,降低TNF-α水平,在结肠组织的结果与血清一致。这表明BL有效减轻DSS治疗小鼠的结肠炎症状。
(3) 肠道菌群失调
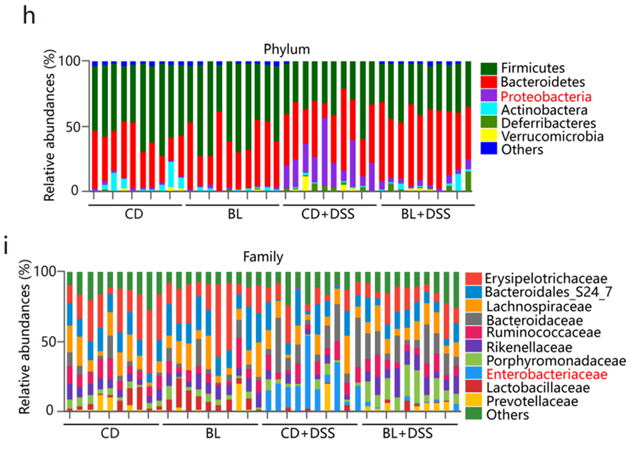
溃疡性结肠炎通常与肠道菌群失调有关,DSS处理诱导了肠道菌群失调(图f)。相比DSS组,BL+DSS组的微生物群更接近于CD和BL组,这表明BL对DSS诱导的菌群失调有保护作用。BL显著缓解DSS诱导的细菌丰度和多样性下降(图g)。
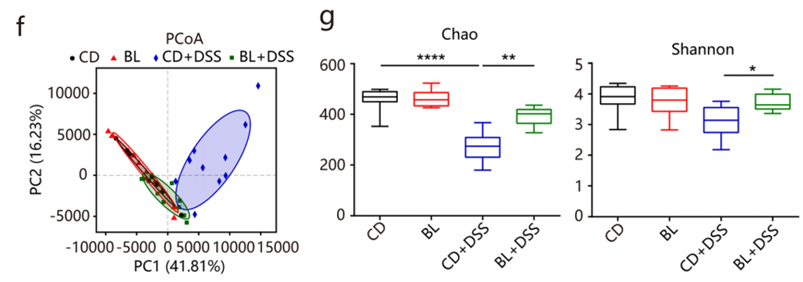
在门和科水平,BL显著降低DSS诱导的Proteobacteria相对丰度增加(图h);DSS处理导致肠杆菌科(Enterobacteriaceae)的丰度急剧增加,这是肠道菌群失调的常见特征,而补充BL能缓解上述菌群变化(图i)。
(4) 前期预防有助于缓解DSS诱导的结肠炎
为了评估预防性或治疗性环境是否有助于预防DSS诱导的结肠炎,分别在DSS治疗前(beBL)或期间(duBL)小鼠补充BL。beBL治疗组改善了小鼠体重减轻、DAI严重程度和结肠长度缩短,效果与BL组相似。同样,结肠切片组织学分析显示,CD+DSS组和duBL+ DSS组小鼠出现严重的固有层和粘膜下层的隐窝扭曲、杯状细胞丢失和炎症细胞浸润,而beBL+DSS组和BL+DSS组的炎症细胞浸润明显消失。综上所述,饲粮中添加BL可预防DSS诱导的结肠炎和肠道微生物群失调。
二、功能研究:BL增强结肠蠕动,改善黏膜屏障功能
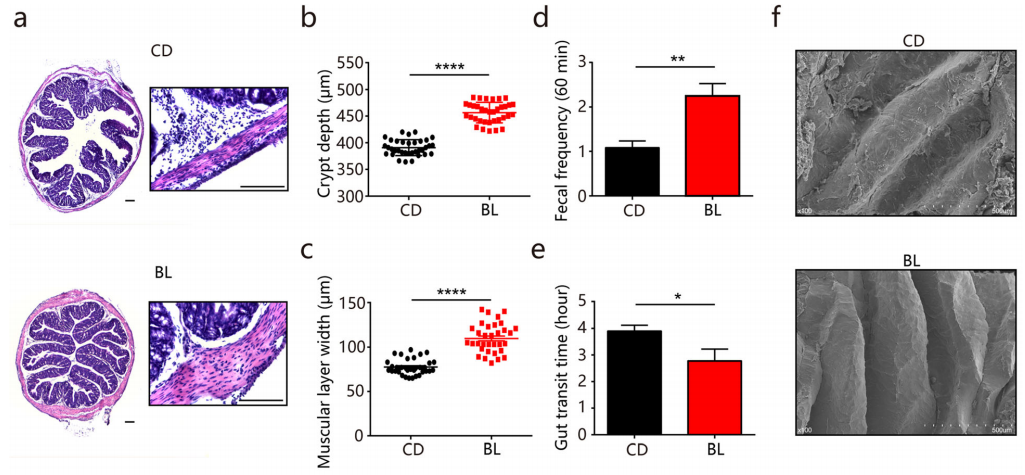
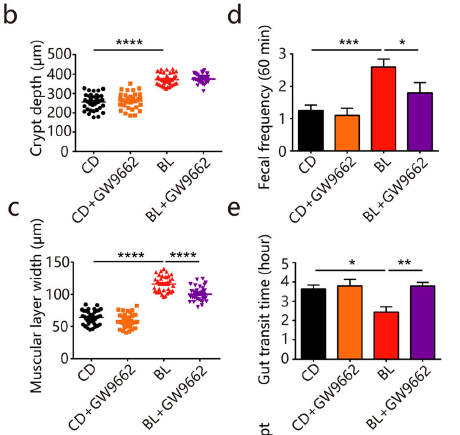
(1) 肠道形态学与结肠蠕动
BL处理组的结肠隐窝高度和肌肉层宽度显著增加(图a-c),而小肠中未观察到形态学改变。肌肉层的协调收缩可促进肠道运动,BL组小鼠大便频率的确相应地增加,且肠道转运时间缩短。电镜图像显示,BL组表现出超形态学的显著改变,说明BL可通过改善肠道屏障功能提升保护效应。相比之下,紧密连接蛋白和和抗菌肽表达水平并没有差异,巨噬细胞和中性粒细胞浸润水平也基本相当。
(2) BL对粘膜屏障功能的影响
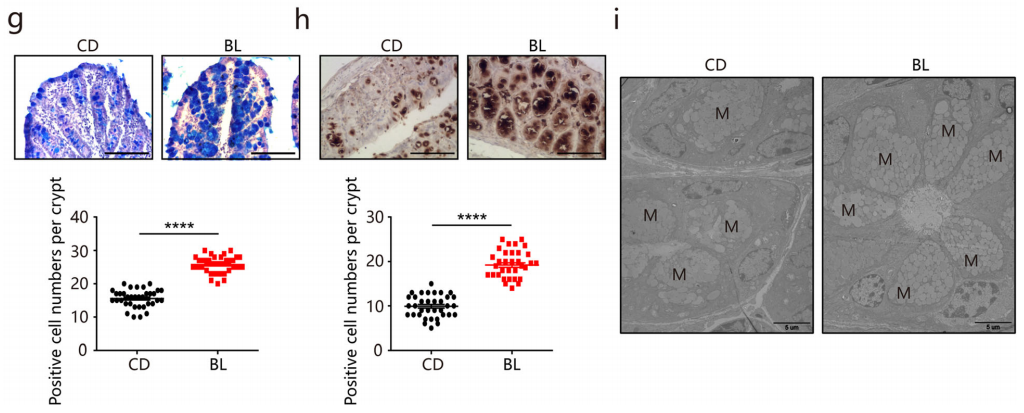
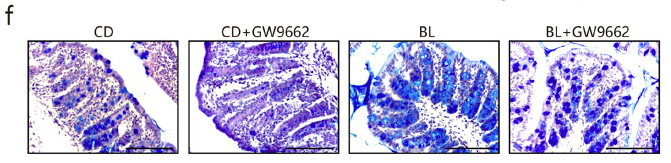
为了进一步考察BL对粘膜屏障功能的保护作用,作者重点关注了结肠黏液层的改变。Alcian blue staining 染色显示,BL组结肠杯状细胞显著增加,其粘蛋白颗粒在粘膜表面的顶端胞吐作用和分泌也增强(图g-i)。粘蛋白2 (Muc2) 是形成粘液层的最丰富的粘蛋白,被高度糖基化并由杯状细胞分泌。免疫组化显示Muc2阳性的杯状细胞明显增多,透射电镜分析进一步证实了上述结果。
三、信号通路研究:BL 作用依赖于PPARγ 信号通路
(1) 结肠组织基因表达谱与PPARγ 信号激活指标变化
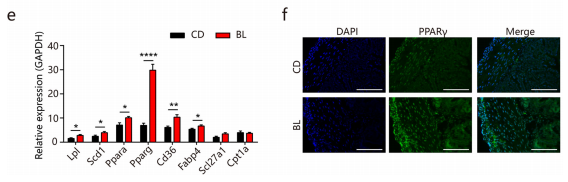
为进一步阐明BL对小鼠肠道运动和黏膜屏障功能改善的机制,研究者进行了结肠转录组分析,结果显示:BL组小鼠结肠912个基因上调,823个基因下调,PPAR信号是最显著富集的功能通路,而富含PPAR信号的显著改变的基因主要参与营养代谢,如脂质生物合成、降解、储存和转运等,这与之前研究一致。STRING分析进一步描述显著变化基因的相互作用网络(图3a-d)。
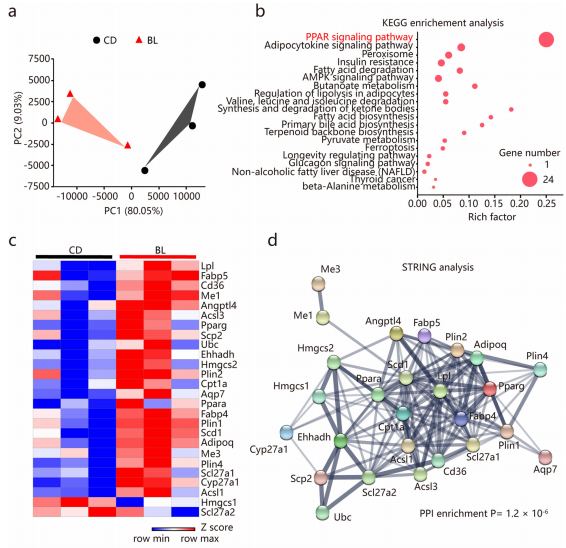
定量 PCR显示,Pparg是 BL组变化最显著的基因(图e)。免疫荧光成像显示:BL组结肠组织PPARγ 蛋白表达增加(图f)。以上表明,BL 处理导致与营养代谢相关的基因发生改变,PPARγ 信号的激活可能有助于BL对肠道功能的影响。
(2) BL调控肠道功能依赖于PPARγ 信号
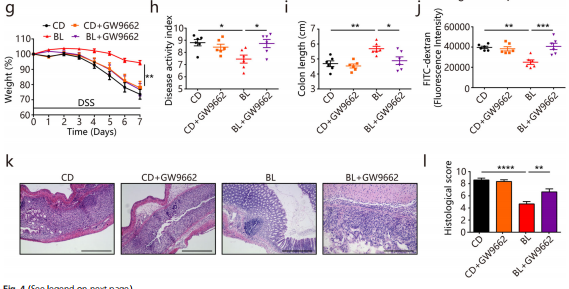
为了评估PPARγ信号通路是否与改善肠道功能有关,研究用PPARγ信号拮抗剂GW9662每日灌胃给小鼠。GW9662抑制PPARγ信号通路:消除了BL对肌肉层宽度、粪便频率、肠道蠕动(图c-e)的改善作用;减少了产生Muc的杯状细胞的数量;降低了结肠炎的保护作用(包括体重、DIA得分、肠道通透性、结肠长度等)(图4g- j);减缓了BL对DSS诱导的上皮损伤的保护作用(图4k-l)。综上所述,这些结果表明BL可能通过激活PPARγ信号通路来保护DSS诱导的结肠炎。
四、深入机理研究:BL促进肠道微生物群来源的嘌呤代谢物的富集
膳食营养素对微生物的代谢物的调节具有很大影响,被认为是宿主-微生物群相互作用的关键介质。BL影响肠功能的潜在机制可能是通过肠道微生物产生的代谢物。
(1) BL对肠道内容物和血清的代谢组影响
对BL和对照小鼠的结肠内容物和血清进行非靶向代谢组学分析, 代谢水平发生显著变化,结肠内容物16种代谢物上调、7种下调,血清中14种代谢物上调,14种下调(图c-d)。显著富集通路多与葡萄糖、脂质和氨基酸代谢等能量和养分代谢相关,嘌呤代谢是最为显著影响的途径(图e-f)。而参与嘌呤代谢中间代谢物肌苷和鸟苷变化也最为显著,经体外发酵培养进行了进一步验证。
(2) 抗生素处理验证微生物对代谢物的直接影响
为进一步判断肠道微生物群是否与BL喂养小鼠中肌苷和鸟苷的富集有关,进行广谱抗生素处理,结果显示:抗生素治疗显著降低了这两种嘌呤代谢物的水平(图g-h)。
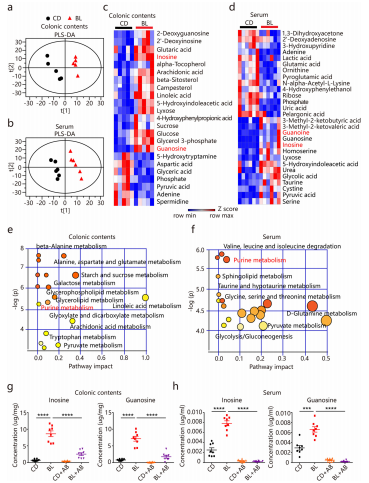
(3) BL通过肠道微生物群影响结肠组织中的代谢重编程
BL通过肠道菌群影响肌苷和鸟苷的富集,可能进一步影响对肠道功能。非靶代谢组研究表明,BL组和对照组结肠组织出现明显的代谢物聚类,显著差异的代谢物大多与能量代谢有关,表明 BL可能通过增强糖酵解途径促进结肠运动。抗生素处理后,BL引起的代谢改变消除。以上结果表明BL通过肠道微生物群依赖性方式诱导结肠组织中的代谢重编程。
(4) 体外验证微生物对肌苷、鸟苷产生机制
新鲜小鼠粪便培养BL体外发酵后,肌苷和鸟苷水平显著增加。为了阐明肌苷和鸟苷积累的机制,通过16S测定培养12h和24h的菌群组成,BL发酵组多样性下降,表明BL发酵导致特定细菌类群的损失。BL能显著提高Lactobacillus的丰度,且Lactobacillus的丰度与肌苷和鸟苷的浓度呈显著正相关(R=0.89-0.93)。以上结果显示:Lactobacillus可能有助于肌苷和鸟苷的富集。
五、体外机理验证:肌苷激活人结肠上皮细胞中的 PPARγ 信号及功能
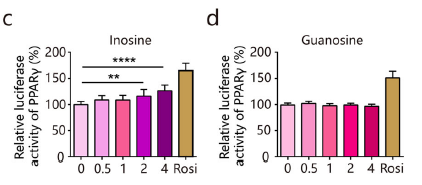
为验证代谢物能够直接影响肠上皮细胞的功能,研究者在体外评估了肌苷和鸟苷的功能活性。用肌苷处理后,细胞中 PPARγ-荧光素酶活性显著增加,但在鸟苷处理的细胞中没有效果(图c-d),表明肌苷而非鸟苷可能是BL 诱导的PPARγ信号激活的代谢物。
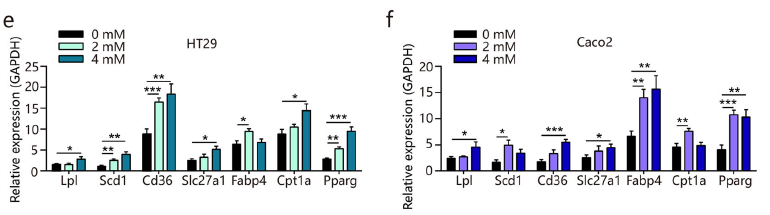
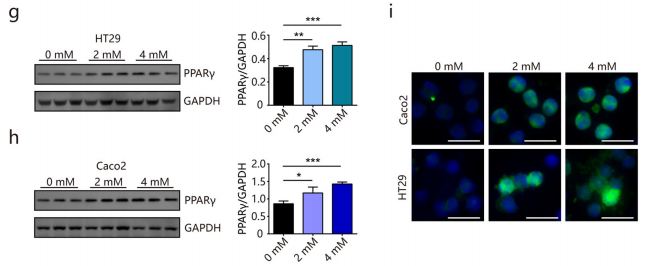
此外, PPARγ 信号通路中关键基因的表达显著增加,如脂质降解基因Lpl、脂质生物合成基因Scd1等(图e-f)。蛋白质印迹和免疫荧光成像进一步证实肌苷添加引起的PPARγ 蛋白水平升高(图g-i)。
进一步通过 siRNA抑制 PPARγ 表达及PPARγ敲低细胞研究,证明肌苷至少部分通过腺苷2A受体(A2AR)/ PPARγ途径诱导粘蛋白的表达。
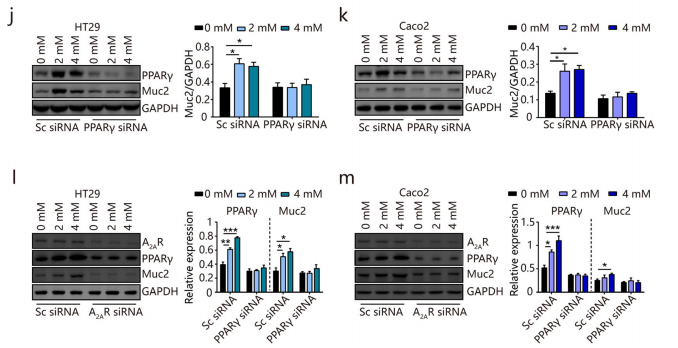
六、体内机理验证:肌苷通过 A2AR/PPARγ改善肠道功能及结肠炎
(1) 肠组织PPARγ激活
肌苷处理导致结肠组织中PPARγ及其靶基因的表达显著增加(图a-c)。
(2) 肠道形态及肠蠕动及肠粘膜屏障功能
肌苷对肠道形态的影响与BL处理一致:结肠肌肉层宽度显著增加(图d-e),进而增加排便频率和减少肠道转运时间来增强肠道蠕动(图f-g)。肌苷处理增加产生粘液的杯状细胞数,进而改善粘膜屏障功能(图h)。反之,用 GW9662或A2AR特异性拮抗剂SCH58261处理后,肌苷未能诱导上述作用(图e-h)。
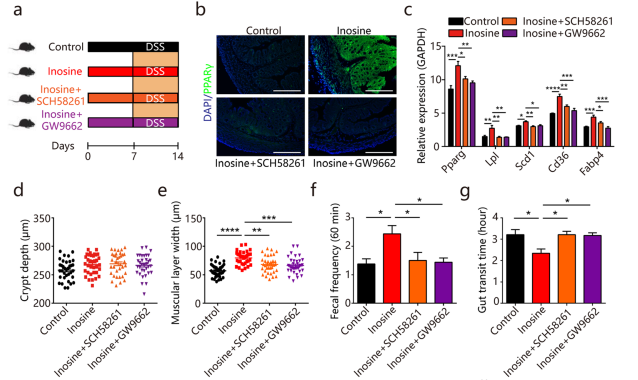
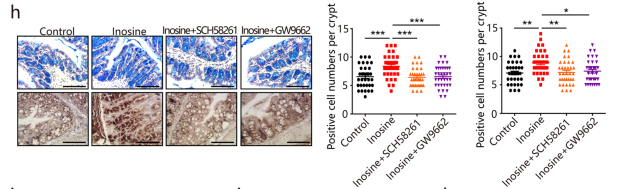
(3) 对DSS诱导的结肠炎保护作用
肌苷减少了 DSS 诱导的体重减轻、减弱的 DAI 评分和结肠缩短(图i-k),增强屏障功能并改善肠道通透性和组织学损伤(图l-n)。当GW9662或SCH58261治疗,肌苷对结肠炎的有益作用消失(图i-n)。以上研究表明:肌苷对结肠炎发挥保护作用部分通过A2AR / PPARγ 信号传导。
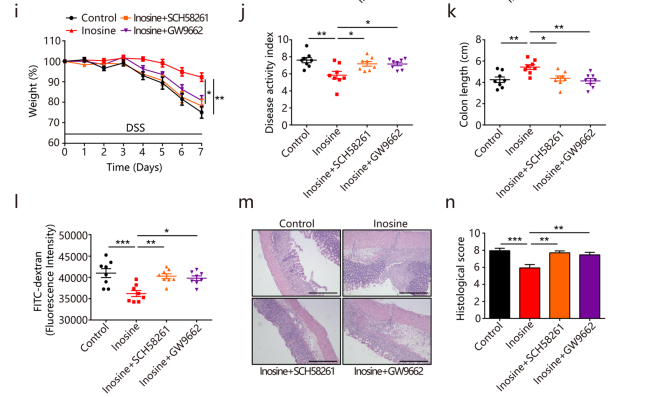
主要结论
大麦叶(BL)可改善葡聚糖硫酸钠(DSS)诱导的肠道微生物群失调,其对结肠炎的保护机制:通过肠道微生物产生腺苷,腺苷激活过氧化物酶体增殖物激活受体(PPAR)γ信号通路,进而改善肠粘膜屏障等功能。此外,肌苷补充的外源性治疗可产生与BL相似的结肠炎保护作用。本研究为BL对结肠炎保护作用潜在机制提供了新的见解,并论证BL和肌苷在预防溃疡性结肠炎中的潜在应用。
该研究的整体思路非常清晰,从表型药效到机理追溯层层递进:药效←功能←信号通路←活性分子→ 体外活性与机制验证→体内活性与机制验证。

