3 - 250 μm
X*Y:12×12 mm Z:12 mm
加载模式
准静态(单点,矩阵)
蠕变,应力松弛
DMA动态扫描 (E', E'', tanδ)
作者:杭州轩辕科技有限公司 2023-05-05T00:00 (访问量:5424)
3 - 250 μm
X*Y:12×12 mm Z:12 mm
加载模式
准静态(单点,矩阵)
蠕变,应力松弛
DMA动态扫描 (E', E'', tanδ)
新型光纤干涉式悬臂梁探头,利用干涉仪来监测悬臂梁形变。
创新型光纤探头,弥补了传统纳米压痕仪无法测试软物质的问题,也解决了AFM在力学测试中的波动大,操作困难、制样严苛等常见缺陷。
● 背景噪音低:激光干涉仪抗干扰强于AFM反射光路
● 制样更简单:对样品的粗糙度宽容度高于AFM
● 刚度选择更准确:平行悬臂梁结构有利于准确判别压痕深度与压电陶瓷位移比例关系,便于选择合适刚度探头来保证弹性形变关系的稳定性,进而获得重复率更高、准确性更好的数据
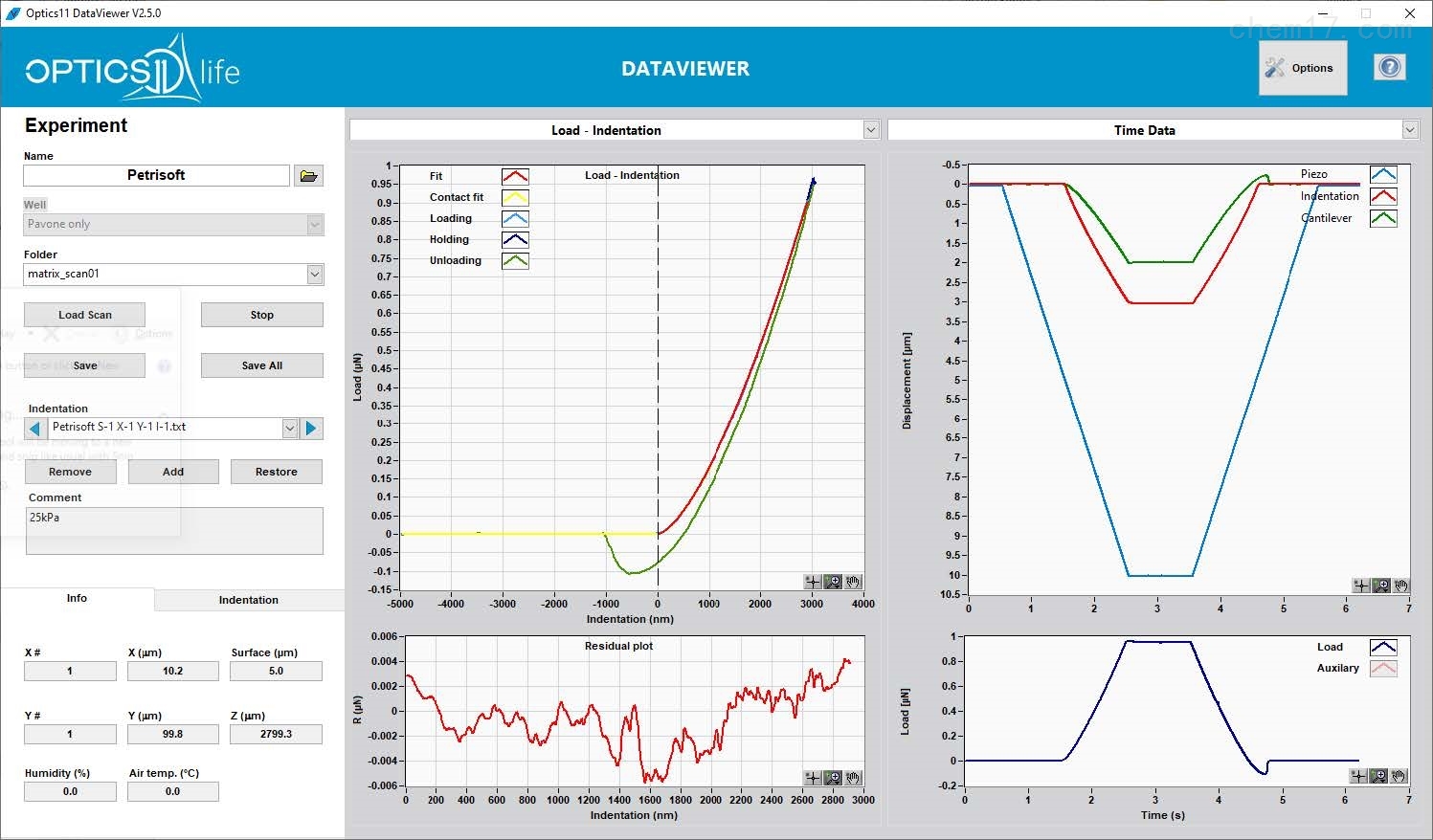
● 借助功能强大而易于操作的软件,用户可以自由控制压痕程序(载荷、位移等)。自动处理曲线的流程,可以获得数据和结果的快速分析
● 原始参数完整txt导出,便于后续复杂处理的需要
● 利用Hertz接触模型从加载部分计算弹性模量,与常用的Oliver&Pharr方法相比,更为适合生物组织和软物质材料特性
| 年 份 | 期 刊 | 题 目 |
|---|---|---|
| 2022 | Advanced Functional Materials | Engineering Vascular Self-Assembly by Controlled 3D-Printed Cell Placement |
| 2022 | Biomaterials | Hydrogels derived from decellularized liver tissue support the growth and differentiation of cholangiocyte organoids |
| 2021 | Biofabrication | 3D bioprinting of tissue units with mesenchymal stem cells, retaining their proliferative and differentiating potential, in polyphosphate-containing bio-ink |
| 2021 | nature communications | Janus 3D printed dynamic scaffolds for nanovibration-driven bone regeneration |
| 2020 | Environmental Science & Technology | Effect of Nonphosphorus Corrosion Inhibitors on Biofilm Pore Structure and Mechanical Properties |
| 2020 | Acta Biomaterialia | A multilayer micromechanical elastic modulus measuring method in ex vivo human aneurysmal abdominal aortas |
具有高空间分辨率和力灵敏度的纳米压痕技术广泛用于测量硬质生物材料和组织的机械性能。然而,其分析软生物材料和器官的可靠性尚未经过测试。在这里,我们评估了纳米压痕测量软生物标本的被动力学性能的效用。从C57BL / 6 N小鼠中收获肾脏,肝脏,脾脏和子宫样品。我们使用Bland-Altman图,类内相关系数(ICC)和受试者内变异系数(COV)评估了生物标本和水凝胶对照中的测试-复测试重复性。结果使用Hertzian,JKR和Oliver & Pherr模型计算得出。与水凝胶类似,所有生物标本的Bland-Altman图在刚度测试和复试检查中表现出良好的可靠性。在所有三种模型中,ICC均大于0.8,COV小于15%。在肾脏,肝脏,脾脏和子宫中,ICC仅在Hertzian模型中始终大于0.8,而在JKR和Oliver & Pherr模型中则不然。同样,仅在赫兹模型中肾脏、肝脏、脾脏和子宫的COV始终小于15%,而在其他模型中则不然。我们得出结论,纳米压痕技术在检测肾脏,肝脏,脾脏和子宫的硬度方面是可行的。赫兹模型是提供所研究生物标本离体器官刚度可靠结果的首选方法。
从5周,10周,20周和30周龄C57BL / 6 N小鼠解剖肾脏,肝脏和脾脏。对于肾脏和脾脏,使用每种性别和年龄的2只小鼠。对于肝脏,使用每种性别和年龄的2至4只小鼠。对于子宫,使用了八只小鼠,所有这些小鼠都在100天左右。这些实验得到了当地动物护理委员会(LAGeSo,德国柏林)和马克斯·德尔布吕克分子医学中心(MDC)动物福利官员的批准(编号X 9011/19)。
具有不同刚度的水凝胶(1 kPa,2 kPa,4 kPa,8 kPa,12 kPa和25 kPa)从Softwell,Matrigen,Matrigen Life Technologies,Brea,CA购买,用于质量控制(1 kPa,2 kPa,4 kPa,8 kPa,12 kPa和25 kPa;N = 1 到 3)。
左肾和右肾分别从侧中线分为两个(图)。3A),四个部分全部缩进。肝脏样本取自左叶(图)。四A). 整个收获脾脏用于实验(图)。4选择并打开左子宫角(图)。5答,B)。所有器官都经过清洁,去除器官表面可见的血液,脂肪,膜或血管,但避免损坏它们的实质。为了获得平坦的表面,我们将所有样品粘贴到直径为6厘米的培养皿底部,并用虫胶(Sigma)使外表面平整。将组织样品浸入PBS(NaCl 4.0 M,KCl 137.0 M,Na2高原油40.01 米,千米2采购订单40.0018米;酸碱度 7.4)。
为了确定弹性特性,我们使用了位移控制的纳米压痕仪(Piuma;光学11,荷兰阿姆斯特丹)。该设备采用套圈顶部悬臂探头32,33施加负载并使用基于光纤的读数同时测量压痕深度(图)。1A). 我们使用半径为 50 μm 且悬臂刚度为 0.5 N/m 的球形探头。在每一系列实验之前,通过压入刚性表面并将悬臂弯曲等同于探头位移来进行悬臂弯曲校准。之后,将探针聚焦在组织表面的适当区域(图。1B、3A、4A、5A、6B)。在25×5 μm网格扫描中,将每个凝胶压痕5次(800×800个基质),测量间隔距离为200 μm。肾脏、肝脏和脾脏样品在9××3μm网格扫描中用3个压痕(200个基质)压进(图。200B、3B、4B)。在子宫中,分别在子宫的近端、中部和远端测试了 5 × 4 μm 网格中具有 100 个单压痕的三个压痕矩阵(图)。100B,C)。应用的压痕方案由在6 nm压痕深度下4 s的加载阶段(保持8000秒)和卸载阶段4 s组成。所有扫描都进行了两次,以分析可靠性。左右肾四个部分所有结果的平均值表示为肾脏弹性。凝胶、肝脏和脾脏的硬度表示为每次扫描中所有结果的平均值。三次扫描结果的平均值作为子宫硬度。所有单个压痕值均由 Piuma Dataviewer 版本 2.2 (Piuma;光学11,荷兰阿姆斯特丹)。
Piuma纳米压痕技术已广泛应用于硬动物器官的生物材料刚度研究,例如骨骼25、耳内、鼻翼和鼻外隔细胞和细胞外基质 (ECM) 水平24,26,在膝关节22,在关节软骨中23.其他例子是人类供体角膜27、纤维化肠组织30、胰腺无细胞支架31、软板28尤其是钙化的动脉瘤腹主动脉29.该技术在测量软生物材料,特别是离体器官的刚度方面的可行性和可靠性尚不清楚。与硬质生物材料相比,软质生物材料的某些性能,如粘弹性和附着力,更容易出现纳米压痕的偏差。我们的研究是第一个使用这项技术在体外测试软生物器官的刚度,特别是来自小鼠的刚度,这些器官广泛用于模拟人类和动物疾病。我们应用了Piuma纳米压痕技术,该技术易于使用,并利用特定的探针来测量杨氏模量,以匹配组织的特定样品特性42,43,44
地 址: 德信AI产业园c栋 联系人: 邓顺 电 话: 19357158997 传 真: 0571-87089231 Email:shun.deng@cellandforce.com
杭州轩辕科技有限公司
商家主页
CellScale UniVert(拉伸强度测试仪)的论文介绍-水凝胶万能试验机 (暂无发布时间 浏览数:20641)
细胞牵张拉伸加载培养与分析系统与三维细胞(组织)牵引拉伸加载培养与分析 (暂无发布时间 浏览数:21070)
MCTR细胞压力设备-细胞压缩细胞力学 (暂无发布时间 浏览数:19396)
国产细胞拉伸牵张应力加载培养系统介绍 (暂无发布时间 浏览数:21850)
界面力学分析仪-SFA2000表面力仪 (暂无发布时间 浏览数:20421)
SFA2000表面力仪介绍 (暂无发布时间 浏览数:22143)
SFA2000表面力仪开发疏水性和亲水性相互作用的一般相互作用潜力 (暂无发布时间 浏览数:20240)
测量细胞外基质(ECM)的弹性或刚度的仪器 (暂无发布时间 浏览数:19681)
国产细胞牵张拉伸应力加载培养系统 (2023-08-20T00:00 浏览数:21829)
了解机械转导及其在细胞生物学中的重要性-细胞生物组织外基质软硬度杨氏模量 (2023-08-20T00:00 浏览数:23125)