长久以来,肿瘤被认为是孤立的肿块,独立存在于器官特定的部位。在过去的数十年中,通过使用靶向治疗和联合用药方案,肿瘤治疗领域取得了长足的进步。但这些治疗方案中的绝大多数患者最终都无法完全治愈,甚至有些患者在用药初期疗效显著,最终却复发为耐药肿瘤。这是由于肿瘤组织还包括多种类型的基质细胞(成纤维细胞、淋巴细胞、巨噬细胞和内皮细胞)、免疫细胞(T和B淋巴细胞等)和细胞外成分(细胞因子、生长因子、激素、细胞外基质ECM等),它们围绕着肿瘤细胞,并由血管系统滋养,构成了肿瘤微环境(tumor microenvironment, TME)【1】。肿瘤微环境 (TME)为肿瘤提供良好的生长环境及营养物质,促进肿瘤的进展和转移,这些特征导致了个体患者中许多常规治疗的失败。 肿瘤类器官是一种可以在体外模拟病人肿瘤微组织的模型,其样本来源是原代肿瘤组织。类器官结构包含多种特异性细胞类型,空间结构与其对应肿瘤组织相似。目前已有多种类型肿瘤建立了类器官培养方案,如:胃癌、肝癌、胰腺癌、结肠癌、卵巢癌等类器官培养方案已日趋成熟。随着生理学上建模方式的精确和完善,类器官培养技术可以与体外肿瘤微环境(TME)技术相结合,并维持其多样化的细胞群体。
用于模拟肿瘤免疫微环境的类器官培养系统
模拟肿瘤免疫微环境的肿瘤类器官培养可以通过三种途径实现:
I 将肿瘤组织经过物理或酶解分离后,在细胞外基质(Matrigel或BME)中进行类器官培养;同时分离外源性免疫细胞(通常来源于自体外周血或肿瘤组织),随后与生长的类器官进行共培养。这种将类器官完全浸没的培养方式适用于富集上皮类型肿瘤细胞,但不能保留间质细胞,因此需要外源性添加免疫细胞来构建肿瘤微环境【2】;
II 将肿瘤消化后形成的球状组织与胶原蛋白混合,并接种到微流体培养装置中,即肿瘤细胞与样本中的固有免疫微环境共同培养,形成天然TME模型。这种装置的中心部分是用来培养肿瘤微球体的3D凝胶,培养基由两侧的孔隙进行流通,可以实时地、持续地调节肿瘤类器官所处的液体环境,并且也可以模拟在体内依靠血液自然流动的药物递送方式【3】;
III 将含有免疫细胞的肿瘤组织物理切割成组织碎片,在包被胶原蛋白凝胶的transwell小室中进行培养。凝胶的顶部暴露在空气中,同时外皿中的培养基通过可渗透的transwell扩散到内皿中,形成气-液交互界面(air–liquid interface, ALI)。与普通的凝胶培养方式不同,ALI法不仅保留了原始肿瘤的基本特征,还保留了TME复杂的细胞组成和结构【4】。目前黑色素瘤、肾细胞癌(RCC)、非小细胞肺癌(NSCLC)都已经实现ALI法构建肿瘤类器官-TME。
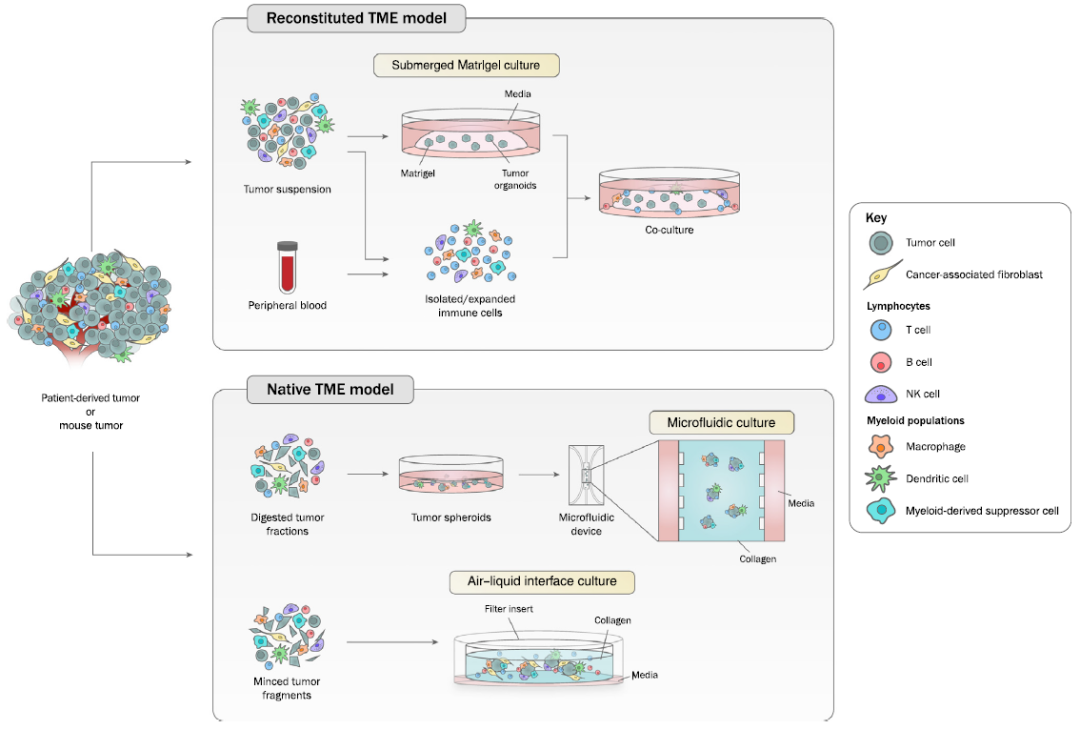
图1. 用于模拟肿瘤免疫微环境的类器官培养系统【5】
类器官作为一种研究模型,在发育生物学、疾病病理学、细胞生物学、再生机制、精准医疗以及药物毒性和药效试验等方面均显示出巨大的应用潜力。为了更好地挖掘类器官技术的应用价值,近岸蛋白特邀类器官研究领域的研究专家和行业大咖共同探讨类器官技术在疾病研究以及转化医学中的应用。报名通道已开启,欢迎报名参加,获取更多关于类器官研究的前沿动态。
时间
2022年6月16日,19:00-21:00
直播日程

肿瘤类器官-TME在研究中的应用
1、用于评估免疫检查点抑制剂的效果
通过对肿瘤患者的临床研究表明,免疫检查点受体信号抑制剂(immune checkpoint inhibitors,ICI)对于治疗肿瘤有一定的协同作用。通过对其安全性和有效性的综合考量,目前有七种单克隆抗体包括一种阻断细胞毒性T淋巴细胞相关抗原4 (CTLA-4),六种阻断程序性细胞死亡蛋白1 (PD-1)或其配体(PD-L1)已被FDA批准用于治疗包括黑色素瘤、皮肤鳞状细胞癌、头颈癌在内的多种晚期癌症,许多其他抗体也在临床测试中【6】。
2、扩大免疫疗法的治疗范围
迄今为止,研究人员寄希望于多种免疫疗法,但绝大部分效果被其内源性或获得性耐药机制抵消了;此外,一些肿瘤组织似乎对ICI不敏感。肿瘤类器官-TME作为一种潜在的免疫研究模型,可以用于优化现有免疫疗法的疗效,并且对新方法进行功能评估。 临床免疫治疗越来越多地探索联合用药方法,即利用多个免疫检查点(如PD-1、CTLA-4、LAG-3、TIM-3、VISTA)的抑制剂与免疫抑制细胞群(如Treg、MDSC)的独特生物学特性进行联合治疗,免疫检查点和TME内局部作用的旁分泌途径(如TGFβ)或趋化因子受体(如CCR4和CXCR4)共同阻断的研究正在进行中。免疫治疗组合的其他潜在靶点(包括JAK-STAT、MAPK、Wnt/β-catenin、NF-κB信号通路等)都可以使用肿瘤类器官-TME模型来进行效果验证。
3、精准医学与免疫治疗效果预测
与TME相结合的患者来源肿瘤类器官(patient-derived organoid, PDO)可以通过记录不同治疗方法(包括化疗和免疫疗法,以及小分子或蛋白质治疗)的抗肿瘤效果,实现在体外预测病人治疗后的反应。在保留肿瘤细胞和自体免疫成分的微流控培养PDO-T体系中,通过监测T细胞对肿瘤的细胞毒性,有助于预测或评估患者对ICI治疗的反应【7】;或者通过流式细胞术、免疫荧光染色的检测方式,由ALI-PDO中多种内源性免疫元件来模拟体内肿瘤对ICI的反应【8】。这些预测方法都需要具有前期大量相关的临床结果支持,但通过我们对免疫疗法效果的筛选,为临床转化治疗提供了方向。 尽管已经建立了许多类型的肿瘤类器官-TME体系,但仍然需要为罕见的肿瘤建立模型以扩大其适用性。体外肿瘤类器官-TME的培养通常需要添加不同于生理条件的细胞因子,如:肾癌类器官培养体系中需要添加R-spondin 1、EGF、FGF-10;而乳腺癌类器官则需要额外添加Neuregulin 1、FGF-7、Noggin。这些添加在培养基中的生长因子水平异常,可能会导致类器官中不准确的生长曲线和异常的药物反应【9】。
近岸蛋白自主研发生产的低内毒素Activin A、FGF系列、HGF、R-Spondin 1、Noggin和Wnt3a等细胞因子,内毒素低至<10EU/mg,具有高活性、高纯度、高批间一致性,为类器官培养设计,已获得市场认可,让您研究放心!
推荐产品
参考文献
【1】MAO, Xiaoqi, et al. Crosstalk between cancer-associated fibroblasts and immune cells in the tumor microenvironment: new findings and future perspectives. Molecular cancer, 2021, 20.1: 1-30.
【2】SATO, Toshiro, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 2009, 459.7244: 262-265
【3】AREF, Amir R., et al. 3D microfluidic ex vivo culture of organotypic tumor spheroids to model immune checkpoint blockade. Lab on a Chip, 2018, 18.20: 3129-3143.
【4】NEAL, James T., et al. Organoid modeling of the tumor immune microenvironment. Cell, 2018, 175.7: 1972-1988. e16.
【5】YUKI, Kanako, et al. Organoid models of tumor immunology. Trends in immunology, 2020, 41.8: 652-664.
【6】VADDEPALLY, Raju K., et al. Review of indications of FDA-approved immune checkpoint inhibitors per NCCN guidelines with the level of evidence. Cancers, 2020, 12.3: 738.
【7】JENKINS, Russell W., et al. Ex vivo profiling of PD-1 blockade using organotypic tumor spheroids. Cancer discovery, 2018, 8.2: 196-215.
【8】KONG, Joseph Cherng Huei, et al. Tumor-infiltrating lymphocyte function predicts response to neoadjuvant chemoradiotherapy in locally advanced rectal cancer. JCO Precision oncology, 2018, 2: 1-15.
【9】LUO, Zhimin, et al. Reconstructing the tumor architecture into organoids. Advanced Drug Delivery Reviews, 2021, 176: 113839.
苏州近岸蛋白质科技股份有限公司,是一家专注于重组蛋白应用解决方案的高新技术企业,主营业务为靶点及细胞因子类蛋白、重组抗体、酶及试剂的研发、生产和销售,并提供相关技术服务。公司定位为医疗健康与生命科学领域原料与技术解决方案的上游供应商,致力于为下游客户提供及时、稳定、优质的产品及服务,助力全球生物医药企业和研究机构的技术与产品创新升级。
详询www.novoprotein.com.cn或致电400-600-0940。
