Na+/H+交换体的运行受SOS途径的控制,这一过程的关键步骤是盐胁迫引起的胞质游离Ca2+含量增加。胞浆Ca2+的这种变化对于调节NADPH氧化酶的运作也是必不可少的,它通过促发性ROS的产生影响阳离子通道的活性。因此,研究比较了上述水稻HKT1;5株系中NaCl诱导的Ca2+流速变化(图3)。实时NaCl处理会引起短暂的Ca2+外流,然而,这种反应在EZ中更强烈,在瞬态反应结束后,Ca2+流速值仍然为负,表明有一些主动的Ca2+外排系统参与其中。Ca2+外排顺序是NIL(SKC1)
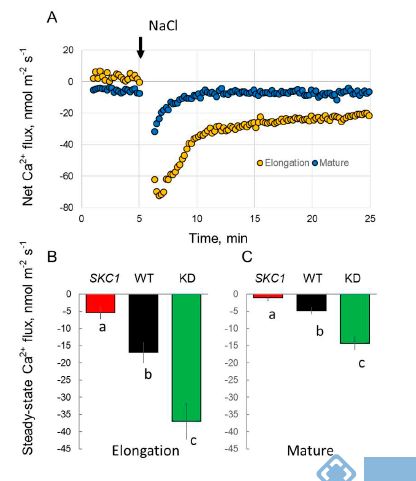
图3. 不同根区的根表皮细胞在80 mM NaCl实时处理下Ca2+流速。(A)WT植株根伸长区和成熟区的瞬时Ca2+流速。(B, C)NIL(SKC1)、WT和Oshkt1,5植株根的伸长区和成熟根区在胁迫后30 min内的Ca2+流速平均值。请注意,此图正值表示吸收,负值表示外排。
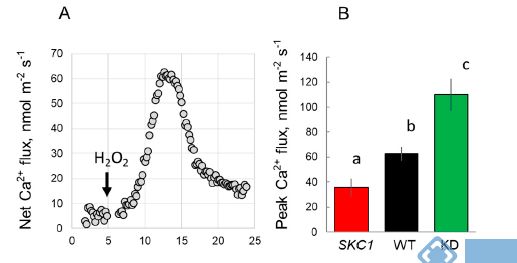
图4. 10 mM H2O2处理下水稻根系伸长区Ca2+流速。(A)WT的根伸长区瞬时Ca2+流速。(B)NIL(SKC1)、WT和Oshkt1,5(KD)根表皮细胞Ca2+流速峰值。请注意,此图正值表示吸收,负值表示外排。
图5. 水稻根伸长区Ca2+流速检测图
其他实验结果
· NIL(SKC1)在伸长区和成熟根区HKT1;5的表达量均显著高于WT,并且HKT1;5的转录水平随着盐度的升高而显著上调。
· 80 mM NaCl处理1周后,NIL(SKC1)株系表现出较为敏感的表型,与WT相比,叶片褪绿坏死比例较大,相对地上部和根系干重显著降低。
· NIL(SKC1)植物在盐条件下积累了较多的K+,但也有较多的Na+。后者的结果显然与SKC1可以去除地上部分Na+的作用不符。
· 研究比较了WT和SKC1植物根系中影响植物离子稳态的一些关键基因表达水平的变化。多个转运蛋白基因的表达水平存在显著差异;这种差异也表现出强烈的时间依赖性和组织依赖性(例如,在伸长区和成熟根区有不同的响应模式)。特别是,NIL(SKC1)在对照和盐胁迫下RBOH转录本的表达均有所降低(在两个根区),而RBOHD在伸长区表达量要高得多。此外,与WT相比,在盐胁迫下,NIL(SKC1)的GORK表达降低,而RBOHD转录本的表达增加。此外,两个根区的SOS1转录水平都较低。
结论
总的来说本研究结果表明,由于生物体内存在多种反馈回路,利用突变体植物获得的结果应该非常谨慎地对待,不能作为有关特定基因作用的机理证据。此外,转录分析和GUS染色可能具有误导性,提供的关于特定转运蛋白运作/功能的信息不完全。因此,需要更加重视植物体的功能检测。
测试液
0.2 mM NaCl, 0.1 mM CaCl2, 0.2 mM KCl, pH 5.5
仪器采购信息
· 据中关村NMT产业联盟了解,佛山科学技术学院于2018年采购了旭月公司的非损伤微测系统。
文章原文:https://doi.org/10.3390/ijms21144882
关键词:盐胁迫;木质部装载;钠;钾;SKC1;HAK5;GORK;RBOHD;表皮;中柱