CRISPR-Cas9基因编辑技术具有广泛的潜在未来应用,包括癌症治疗[1]。目前,CRISPR-Cas9技术的主要安全性问题是宿主对其组分的免疫反应[2-3]和脱靶问题[4]。然而,该技术在RNA水平的安全性问题尚未得到评估。
RNA和MicroRNAs(miRNAs)之间存在广泛的相互作用,不仅发生在mRNA的3’非翻译区域,也发生在mRNA的氨基酸编码序列(CDSs)中[5]。越来越多的研究发现,一种长链RNA可以通过“miRNA海绵”机制结合和吸附与其部分互补的miRNA,上调被这些miRNA抑制的靶基因[6]。
近期,海军军医大学王越团队、上海交通大学医学院附属第九人民医院秦兴军/王业飞团队与美国南加州大学应其龙团队合作在Molecular Cancer杂志上发表题为Optimization of Cas9 RNA sequenceto reduce its unexpected effects as a microRNA sponge的文章,文中研究了外源性长链核酸物质Cas9 RNA是否会通过miRNA海绵机制影响宿主细胞基因表达,并开发了RNA序列优化策略,以提高该基因编辑系统的安全性[7]。

结果
01 Cas9 RNA通过miRNA海绵机制影响细胞内基因表达
为了分析Cas9对其细胞内本身存在的microRNAs及其靶基因的调控作用,研究人员首先挖掘了一个数据库,其中包含过表达Cas9及其对应亲本对照的331个细胞系的转录组信息。作者使用miRanda软件分析了Cas9 RNA和所有已知的人类miRNA之间的结合可能性。
研究人员将预测与Cas9 RNA结合可能性最高的51个miRNAs被命名“Cas9-miRNAs”(图1A-B),而69个不与Cas9结合的miRNAs被命名为“non-Cas9-miRNAs”。根据microRNA海绵假说,在某种细胞中引入Cas9后,某“Cas9-miRNA”的靶基因中,可能存在有更多靶基因表达水平上调的趋势。研究者发现在这331个细胞系中,大多数“Cas9-miRNAs”的靶基因在更多的细胞中存在上述趋势,符合microRNA海绵假说;而“non-Cas9-miRNAs”的靶基因就不存在这样的趋势。这个结果从CRISPR研究领域上讲,提示Cas9的RNA可以通过microRNA海绵机制发挥作用;从RNA相互作用的的基础机制角度上讲,该研究利用几百种细胞系中,单一的,相同干预设计的大样本数据证明了microRNA海绵机制本身的普遍性,虽然在很多细胞中这种效应并不是非常强。
在联合分析miRNA基础表达数据库(CCLE)中的数据后,研究者发现在所有的Cas9-miRNA中,Let-7i是大多数细胞中主要表达的Cas9-miRNA。且Let-7家族成员是众所周知的肿瘤抑制miRNA,因此研究者后续研究将注意力集中在了Cas9的RNA对let-7家族及其下游靶基因的研究中。通过qPCR和Western Blot实验,研究人员证实了在更多类型的细胞中引入Cas9后,一些验证过的let-7靶基因表达上调(U251, 786-O, T98G v.s. MCF7) (图1I-J) 。
此外,研究者还将let-7i的靶基因变化符合microRNA海绵假说趋势的细胞定义为let-7i相关Cas9敏感细胞,反之为let-7i相关Cas9不敏感细胞;对比这两类细胞发现,miRNA本身的表达量和靶基因的基础表达量,以及靶基因的突变状态都会影响Cas9的RNA发挥microRNA海绵效应。这不仅有助于评价Cas9在某种细胞中是否通过microRNA海绵效应发挥作用,也为更广泛的microRNA海绵效应是否存在于某种细胞提供一定预判参考。
进一步,作者分析了其他几种Cas9 RNA通过microRNA海绵机制参与let-7家族靶基因的调控,通过RNA-pulldown实验证实Cas9 RNA可以直接结合let-7(图1N),并且证实在一些肿瘤细胞中,一些let-7靶基因在Cas9导入后有一定程度上调,如CDK6、KRAS、FN1和HMGA(图1O)。在Cas9转基因小鼠中,虽然在大多数作者检测的组织中没发现显著差异,但在少数组织中存在let-7靶基因上调的现象。以上实验结果表明,Cas9 RNA在某些类型的细胞中可以通过miRNA海绵机制调控let-7靶基因,提示Cas9表达系统本身可能通过DNA裂解以外的机制影响细胞。
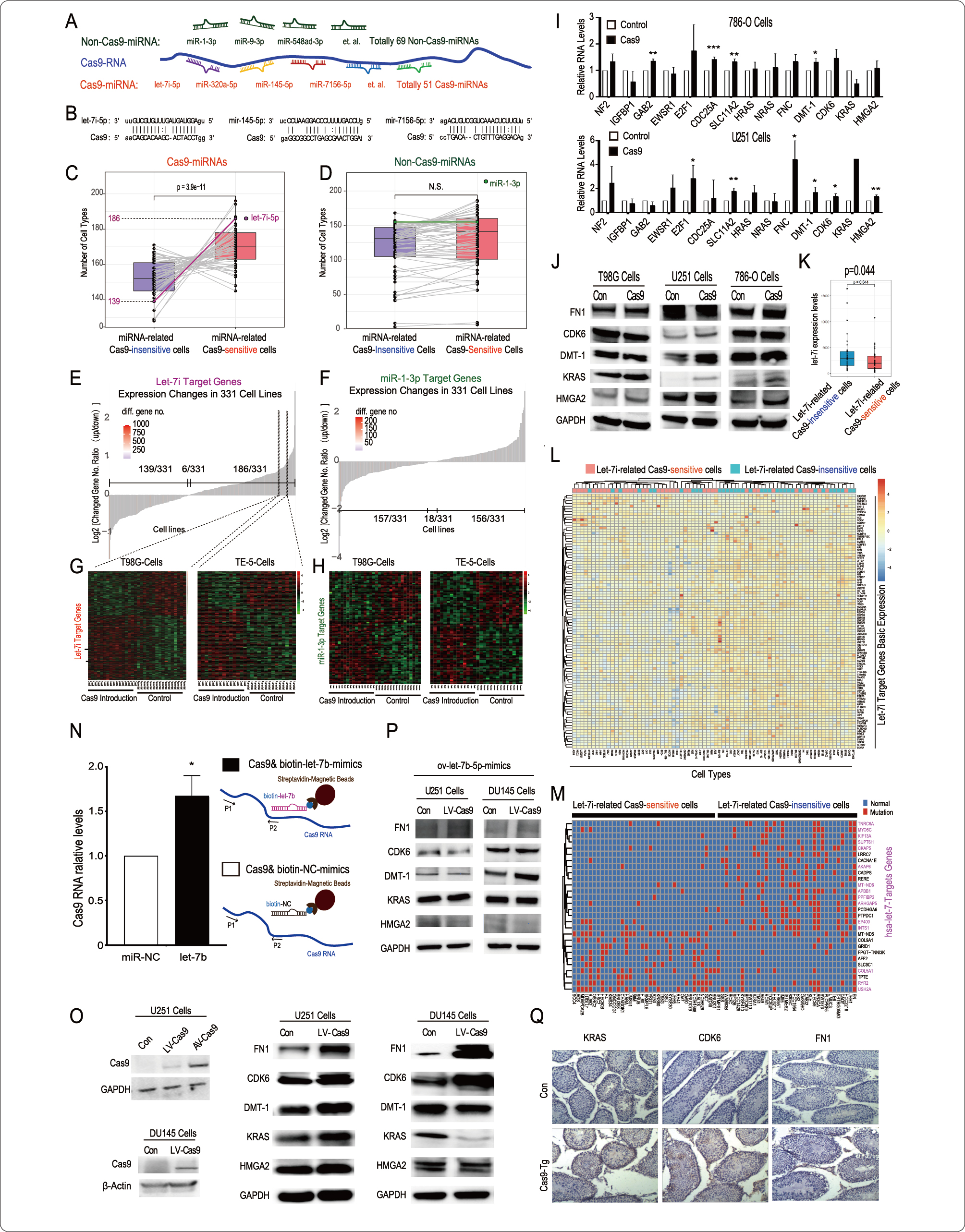
图1 Cas9 RNA通过miRNA海绵机制影响细胞内基因表达
02 Cas9 RNA序列优化降低其对细胞增殖和let‑7下游基因的影响
Let-7下游靶基因大部分为癌基因,由于Cas9可以调控一些let-7靶基因的表达,研究人员推测外源引入Cas9可能会影响细胞的生物学特性。作者将Cas9病毒载体和对照病毒转入人前列腺癌细胞系DU145,发现Cas9在细胞计数中轻度促进细胞增殖和细胞集落形成(图1A)。在体内实验中,研究人员也发现Cas9轻度促进肿瘤细胞的生长(图2B)。
Cas9 RNA可以通过miRNA海绵机制轻微促进某些细胞的增殖,提示除了降低CRISPR-Cas9系统的脱靶效应外,有必要通过修改Cas9本身的RNA来提高CRISPR-Cas9技术的安全性。为了进一步证实这一miRNA海绵机制的存在且在RNA水平上优化Cas9序列,研究人员构建了一个同义突变质粒Cas9-Mut,在三个let-7结合位点发生突变,而Cas9-mut的mRNA转录本可以被翻译成与Cas9相同的氨基酸序列(图2F)。HEK293细胞的RNA-pulldown实验显示,Cas9-mut与let-7的结合比Cas9明显减少(图2G)。
研究人员发现,在DU145细胞(图2J-K)和U251细胞中(图2L),Cas9-mut上调let-7靶基因的能力也明显弱于Cas9。研究者将Cas9-Mut质粒和靶向UBXN4基因的gRNA转入DU145细胞,进一步测试证实了Cas9-Mut的基因编辑能力(图2O),为其在实际应用中提供了支持。
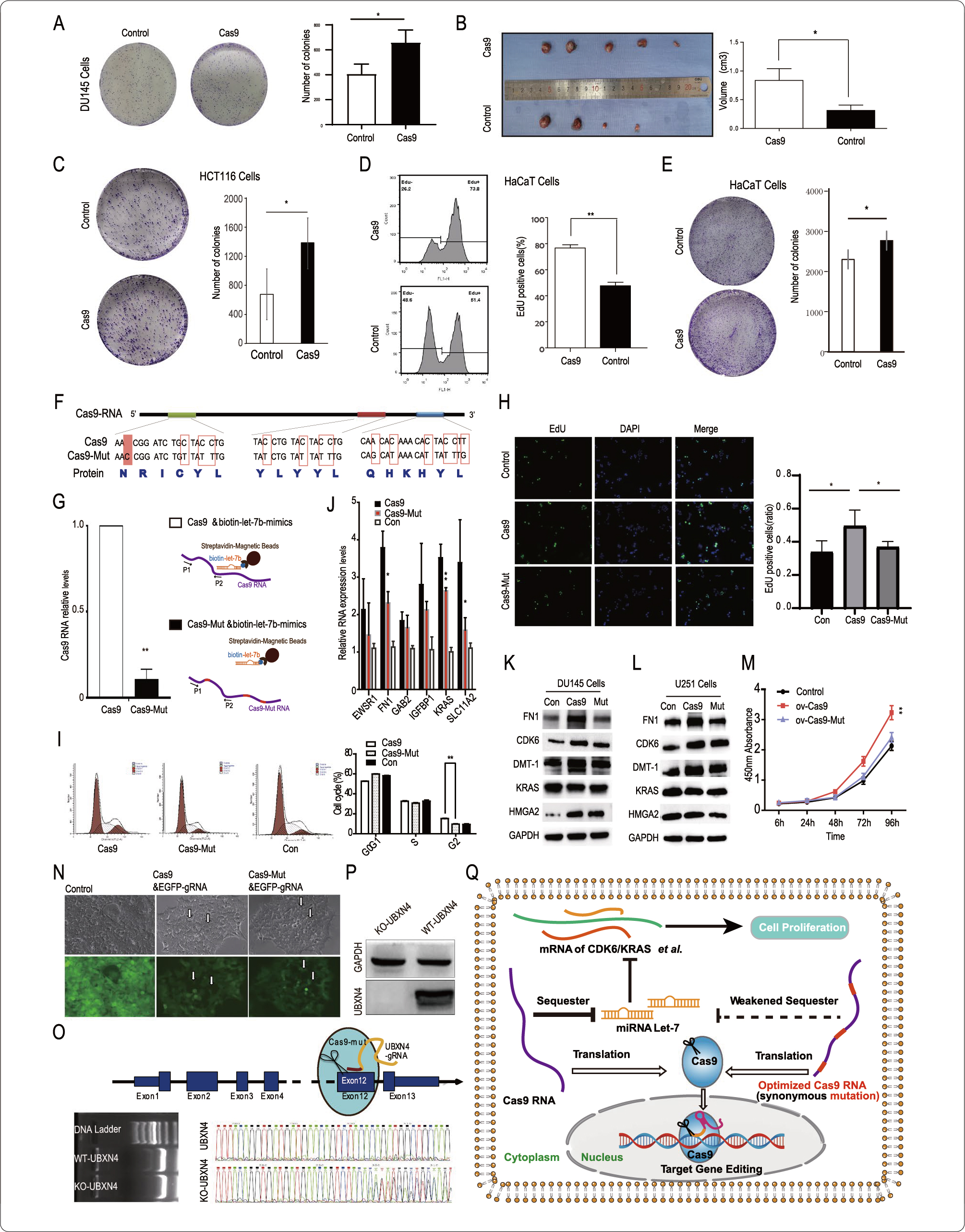
图2Cas9 RNA序列优化降低其对细胞增殖和let‑7下游基因的影响
结论
研究人员通过生物信息学分析和实验结果表明,Cas9的RNA可以通过miRNA海绵机制与内源性miRNA相互作用,Cas9 RNA可以通过结合let-7,上调一些let-7的靶基因,并在某些细胞类型中轻度促进细胞增殖。通过同义突变let-7结合位点,可以优化Cas9的RNA序列,削弱其对细胞增殖和部分let-7下游基因的表达的促进作用。研究者从新的维度认识了CRISPR/Cas9技术的安全性问题,并提出了解决方案,提供了在RNA水平上优化的更安全的CRISPR/Cas9技术, 有一定的应用前景。
海军军医大学的蒋俊锋,曾韬,张莉和范杏飞为文章的第一作者。
和元生物有幸为本研究提供部分病毒包装服务,用实际行动助力科学研究!
参考文献:
[1]Zhang H, et al. Application of the CRISPR/Cas9-based gene editing technique in basic research, diagnosis, and therapy of cancer. Mol Cancer.2021;20(1):126.
[2] Chew WL, et al. A multifunctional AAV-CRISPR-Cas9 and its host response.Nat Methods. 2016;13(10):868–74.
[3]Charlesworth CT, et al. Identification of preexisting adaptive immunity toCas9 proteins in humans. Nat Med. 2019;25(2):249–54.
[4]Kleinstiver BP, et al. High-fidelity CRISPR-Cas9 nucleaseswith no detectable genome-wide off-target effects. Nature.2016;529(7587):490–5.
[5]Tay Y, et al. MicroRNAs to Nanog, Oct4 and Sox2 coding regions modulateembryonic stem cell differentiation. Nature. 2008;455(7216):1124–8.
[6]Xiao G, et al. The long noncoding RNA TTTY15, which is located on the Ychromosome, promotes prostate Cancer progression by sponging let-7.Eur Urol. 2019;76(3):315–26.
[7]Junfeng Jiang,et al.Optimization of Cas9 RNA sequenceto reduce its unexpected effects as a microRNAsponge.Mol Cancer.2022 Jun 24;21(1):136.doi: 10.1186/s12943-022-01604-x.
