细胞转染是指将外源DNA或RNA导入目标细胞中的过程。这一过程可以通过多种方法实现,包括化学法转染、物理法转染、生物法转染等。细胞转染技术在生命科学研究中具有广泛的应用,例如基因表达研究、功能研究、基因治疗和药物开发等。通过转染,可以实现基因编辑、蛋白质表达、信号传导研究等,为揭示细胞机制、开发新药和治疗疾病提供了重要工具。
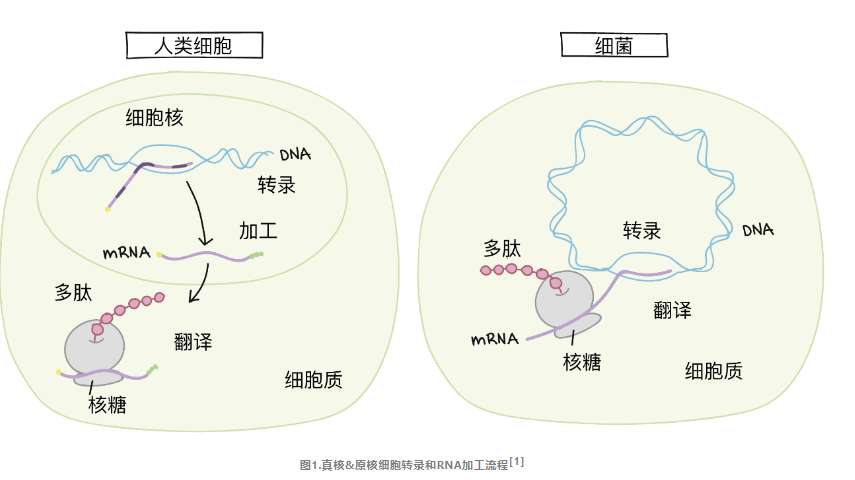
真核生物的转录发生在细胞核中,蛋白质合成发生在细胞质中。因此,一个真核信使RNA必须从细胞核中被运出来才能被翻译成多肽。而原核细胞没有细胞核,所以它们的转录和翻译都在细胞质中进行。
细胞转染主要分为瞬时转染和稳定转染:
稳定转染
是指将外源DNA导入细胞中,目的基因能够入核,并整合到宿主细胞基因组中,通过药物加压筛选,只保留成功转染的阳性细胞,使其在细胞分裂和传代过程中持续稳定地存在和表达。通过稳定转染,外源DNA能够遗传给后代细胞,从而实现长期的基因表达。
瞬时转染
瞬时转染是指将外源DNA或RNA导入细胞中,使其在一段有限的时间内进行高效表达,但是不能随细胞传代而持续稳定表达。瞬时转染通常使用化学转染试剂或物理方法(如电穿孔、微注射等)导入外源DNA,并使其在短暂的时间内表达所需的蛋白质。
常用转染方法及应用
目前转染方法主要包括物理方法、化学方法及生物方法,转染方法的选择取决于细胞类型以及研究目的,即使相同的细胞,不同的转染试剂之间也有较大差异,所以在使用新细胞系时,系统评估转染条件至关重要[2,3]。
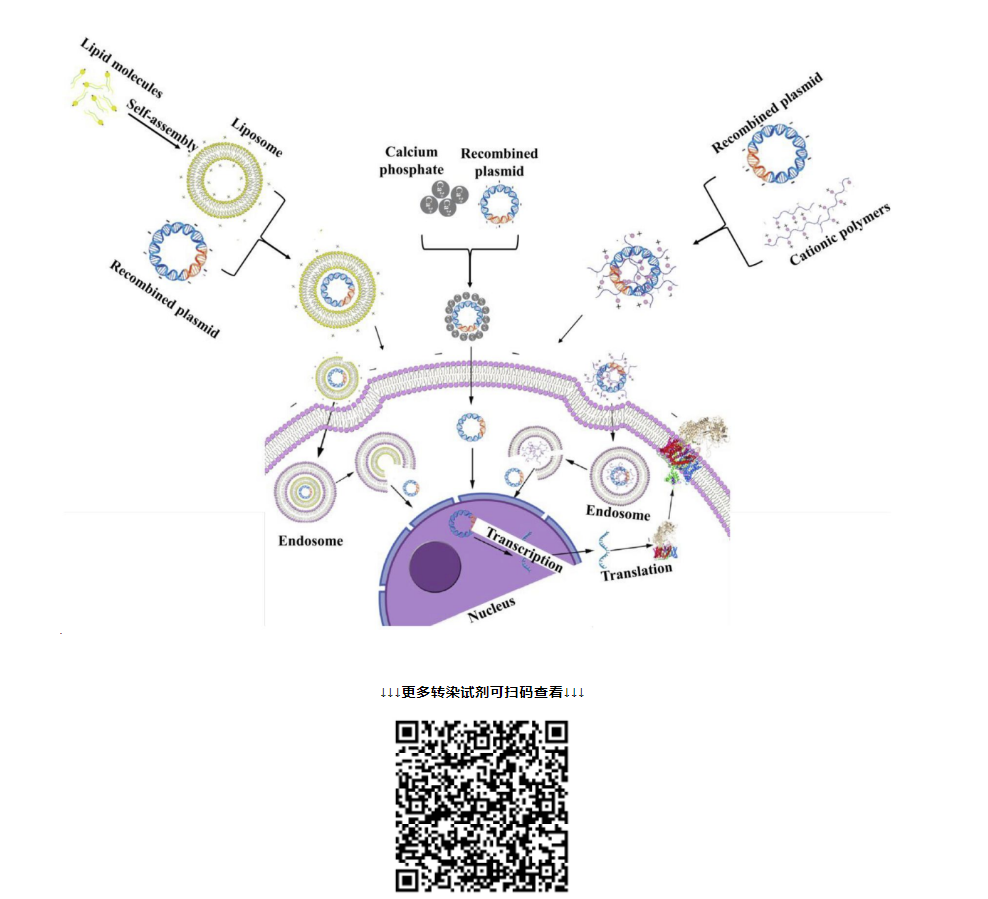

稳定转染和瞬时转染有何异同
相同点:针对质粒DNA,不论是瞬时转染还是稳定转染,都可以通过物理法(电转、显微注射、基因枪),化学法(阳离子脂质体,阳离子聚合物、磷酸钙),生物法(病毒介导)进行转染;并且转染环节的操作基本一致。
差异点:稳转细胞株构建所用质粒,一定是包含抗性基因,便于后续加压筛选;瞬转所用的质粒可以包含抗性基因也可以不包含抗性基因。
瞬时转染和稳定转染常见误区
误区一
稳定转染目的基因会整合到染色体,瞬时转染不会
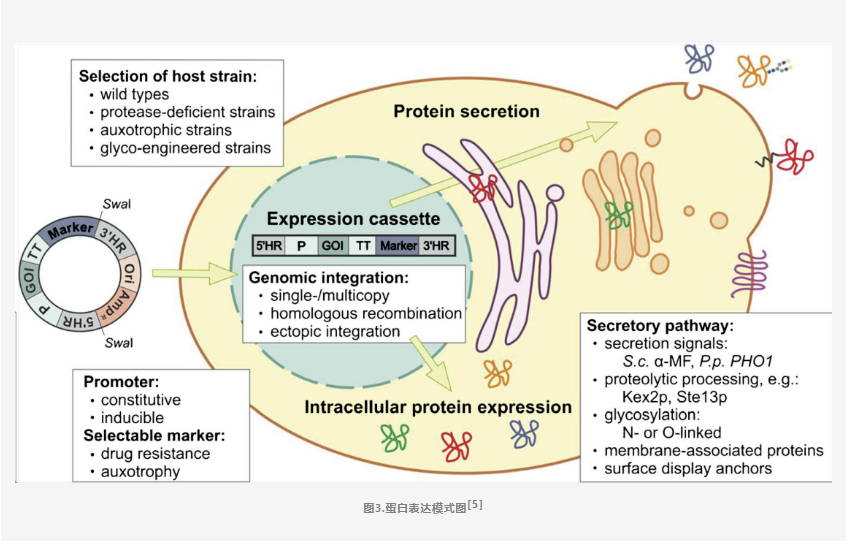
首先我们要了解基因从DNA到蛋白质的过程:DNA被转运至细胞后会入核,DNA在细胞核内,根据碱基互补配对原则,和基因的选择性表达等,转录出mRNA;mRNA通过核孔来到细胞质中的核糖体上,通过高尔基体,内质网等加工,在空间上通过折叠,反转,螺旋等方式形成空间结构。从而形成具有生物活性的蛋白质。一般会分为胞内表达、分泌型、单次跨膜及多次跨膜不同形态。
所以不管是瞬转还是稳转,DNA都会入核并有一定概率随机整合到宿主染色体;唯一的区别在于,稳转所用的质粒含有抗性基因,后期是通过药物筛选,把没有转进目的基因的细胞杀死,保留下来的就是成功转入目的基因的细胞,所以通过一定时间的药物筛选,保存下来的细胞都是能够稳定遗传的细胞,称之为稳定转染;而瞬时转染由于没有药物加压筛选,加上仅有少量的细胞中有目的基因整合到染色体,所以在传代的过程中,阳性细胞会越来越少,导致表达量逐渐降低,进而不能长期稳定表达。
误区二
只有慢病毒感染才能构建稳转细胞株
能够用来做瞬转的转染方法,都可以用来做稳转细胞株构建,比如电转、化学试剂转染、慢病毒感染等,只不过三种转染方法在具体的应用上会有一定差异;需要注意的是RNA转染,由于RNA不需要入核,所以针对RNA转染一般只是做瞬转表达。
误区三
构建稳转细胞株费时费力,周期长,不确定性高,常规实验室不方便构建
1、细胞株构建需要通过药物加压筛选,与瞬转相比周期长,但在进行科学研究时,确定了一个长期研究的靶标,后续都会针对某一基因进行相关实验,那么这个时候构建稳转细胞株就显得尤为必要,毕竟细胞株相较于瞬转来说,最大的优点就是表达稳定性高,批间差异小,实验结果可靠性更高。
2、有的细胞转染效率比较低,通过瞬转的方式,很难获得足够的阳性细胞进行实验,通过构建细胞株,就可以提高阳性率,获得足量稳定过表达的细胞株。
3、有的人可能会觉得构建细胞株周期太久,结果不可控;其实,在我们构建细胞株时,通常会在转染后48h进行表达量检测以及初步的功能验证,这个时候我们就可以知道是否转染成功,就可以知道细胞株构建是否会成功;至于操作难度,这里也可以给大家分享实验protocol(具体操作如下)。
稳转细胞株构建操作流程:
1、重组质粒构建:按照实验室的需求,将目的基因构建到含有抗性基因的载体中(如pLVX-puro),进行无内毒素质粒抽提,获得目的质粒,最终拿到的质粒,浓度最好不低于1000 ng/μL,浓度过低会影响转染效率。
2、细胞准备:在转染前一天传代细胞,保证在第二天能够有70%左右的汇合度(具体情况可根据细胞而定)。
3、细胞转染:按照转染试剂说明书进行细胞转染即可。
4、细胞检测:转染后48h,取部分细胞进行表达量或功能检测,初步判断是否转染成功,若失败,查找失败原因;若成功,则进行后续实验。
5、细胞铺板:细胞计数后,按照10/100/1000个细胞每孔铺板96孔板(铺板数量可以梯度测试),铺板培养基需要含有筛选药物;不建议直接在原细胞中直接加入药物进行筛选,这样会降低细胞存活率。
6、克隆挑选:细胞铺板后14天,显微镜观察克隆生长情况,并将阳性克隆移至12孔板继续培养(根据细胞量转移到合适的细胞培养板即可)。
7、克隆检测:按照实验室检测方法进行表达量或功能验证,筛选出若干个优选克隆继续传代培养,待细胞大量扩培后,可再进行一次复检。
8、细胞建库:按照实验需求进行细胞建库,如果需要构建单克隆细胞株,可以在优选克隆基础上按照单个细胞每孔进行二轮筛选。
细胞转染常见FAQ
问
一般哪些因素会影响细胞转染效率
质粒:首先要确保我们序列的准确性,其次是质粒的高纯度;质粒浓度最好不低于1000 ng/uL(该浓度只是建议浓度,低浓度也可以成功转染,只不过转染效率会有所降低)。
细胞类型:要保证是一个健康状态的细胞;不同细胞类型对转染方法和试剂的敏感性不同,因此转染效率也会有差异。
转染方法:按照转染试剂说明书要求进行转染条件摸索,确定最佳转染条件。
问
通过多种转染方式均无法提高转染效率,应该怎么解决
如果瞬转效率比较低,这时会推荐构建稳转细胞株,可以通过药物加压筛选,获得稳定过表达的细胞株,提高阳性率,解决转染效率低的问题。
问
如何选择合适的转染方法
目前主要有物理方式,化学试剂及病毒等转染方式;通常物理转染需要昂贵的仪器及复杂的转染参数,一般实验室无法满足;化学试剂是目前比较通用的一种方法,因其价格便宜,操做简单,被广泛使用,不过该类产品一般只能转染比较常规的细胞,针对个性化肿瘤细胞其转染效率会下降,所以针对较难转染的细胞,主要是通过慢病毒进行转染;当然,如果细胞本身就是那种非常难转染的,慢病毒也不一定会有很高的转染效率。
问
稳转细胞株构建是否需要将质粒线性化
不需要,质粒线性化和未线性化均可,亲测两种差异不大。
问
报告基因细胞株如何构建
报告基因细胞株构建流程和上述细胞株构建方法基本一致,首先需要确定所用报告基因质粒是正确(涉及到具体的信号通路),根据细胞类型,选用适合的转染方法,按照质粒载体上标注的抗性基因进行药物筛选即可。(翌圣生物提供上百种报告基因质粒产品可供选择)
相关产品
针对细胞转染,翌圣可以提供多款转染试剂,能够匹配更多应用场景,如常规DNA转染、siRNA/miRNA转染及病毒包装转染试剂等,其中PEI转染试剂能够提供GMP级别产品,支持项目申报。
|
产品名称 |
货号 |
应用 |
|
Hieff Trans® Liposomal Transfection Reagent 脂质体核酸转染试剂 |
40802ES |
转染DNA,文章高引用产品 |
|
Hieff Trans®siRNA/miRNA体外转染试剂 |
40806ES |
转染siRNA/miRNA |
|
Calcium Phosphate Cell Transfection Kit 磷酸钙法细胞转染试剂 |
40803ES |
转染DNA,效率高,成本低 |
|
Polyethylenimine Linear (PEI) MW40000(rapid lysis) 线性PEI转染试剂(速溶型)MW40000 |
40816ES |
PEI转染试剂(粉末) |
|
Hieff Trans® PEI转染试剂 |
40820ES |
PEI转染试剂(科研级) |
|
Hieff Trans® PEI Transfection Reagent-GMP |
40821ES |
PEI转染试剂(GMP级) |
参考文献
[1]https://zh.khanacademy.org/science/biology/gene-expression-central-dogma/central-dogma transcription/a/intro-to-gene-expression-central-dogma
[2] Hamm A, Krott N, Breibach I, Blindt R, Bosserhoff AK. Efficient transfection method for primary cells. Tissue Eng. 2002 Apr;8(2):235-45. doi: 10.1089/107632702753725003. PMID: 12031113.
[3] Badakov R, Jaźwińska A. Efficient transfection of primary zebrafish fibroblasts by nucleofection. Cytotechnology. 2006 Jun;51(2):105-10. doi: 10.1007/s10616-006-9018-3. Epub 2006 Sep 21. PMID: 19002901; PMCID: PMC3449684.
[4] Guo X, Ma Y, Wang H, Yin H, Shi X, Chen Y, Gao G, Sun L, Wang J, Wang Y, Fan D. Status and developmental trends in recombinant collagen preparation technology. Regen Biomater. 2023 Nov 29;11:rbad106. doi: 10.1093/rb/rbad106. PMID: 38173768; PMCID: PMC10761200.
[5] Ahmad M, Hirz M, Pichler H, Schwab H. Protein expression in Pichia pastoris: recent achievements and perspectives for heterologous protein production. Appl Microbiol Biotechnol. 2014 Jun;98(12):5301-17. doi: 10.1007/s00253-014-5732-5. Epub 2014 Apr 18. PMID: 24743983; PMCID: PMC4047484.
