论文标题:RNA N6‐methyladenosine methyltransferase‐like3 promotes liver cancer progression through YTHDF2‐dependent posttranscriptional silencing of SOCS2
刊登日期:2018年05月
发表杂志:Hepatology
影响因子:13.246
研究机构:香港大学李嘉诚医学院
2017年二军大东方肝胆医院孙树汉课题组曾于肝病学顶级期刊Hepatology上报道了在肝癌HCC中,METTL14表达水平显著下调,使得RNA整体的m6A甲基化水平降低,继而影响抑癌分子miR-126(案例解析:RNA甲基化转移酶METTL14影响肝癌转移),从而最终影响HCC的转移和侵袭。但是时隔一年多,同样在Hepatology,杂志意味深远地发布了颇具挑战性的研究。来自香港大学的研究人员发现,METTL3的过表达与HCC的不良预后相关。体外细胞实验证实敲除METT3后能够显著抑制肝癌的增殖迁移以及肺转移。SOCS2作为METTL3修饰的靶基因,由于m6A甲基化水平提升,更容易被YTHDF2降解,最终导致肝癌恶化。两项研究结果大相径庭,意味着在RNA甲基化领域,目前仍然有较多的工作等待我们去挖掘和开发。这些争议将推动RNA甲基化朝着更好的方向前进。
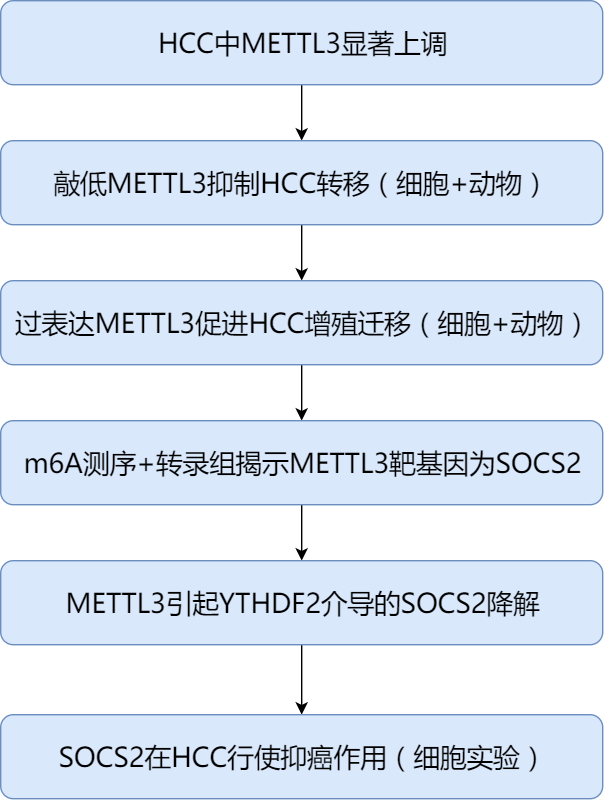
2.流程图
3.HCC中METTL3显著上升
通过对16对HCC病人肝癌组织和癌旁组织转录组分析表明,METTL3显著上调,而其余几种常见的甲基化酶并无差异。
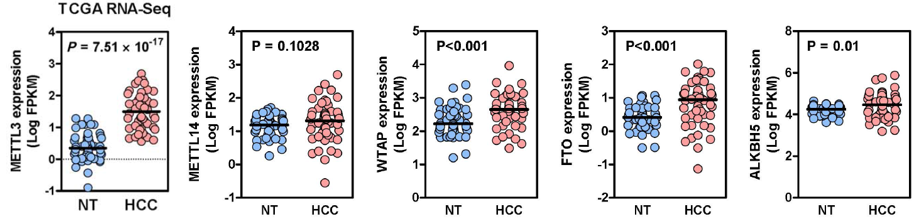
通过对TCGA转录组数据库50对HCC病人的肝癌组织和癌旁组织的数据分析后发现其结果也和HKU转录组数据一致。
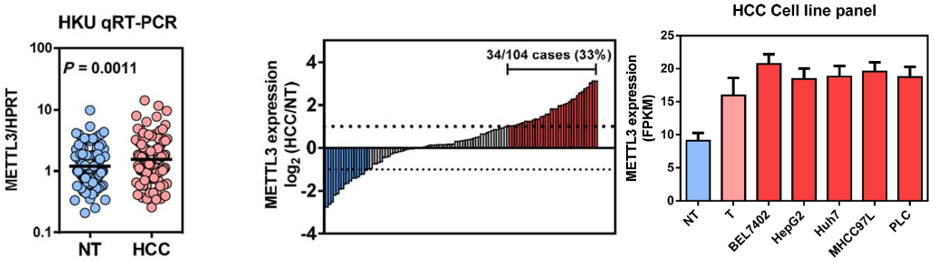
对104个HCC病人中METTL3表达水平进行了定量PCR验证后发现显著上调,其中34例上调极显著。在多种肝癌细胞系中,METTL3的表达水平也是显著上升。
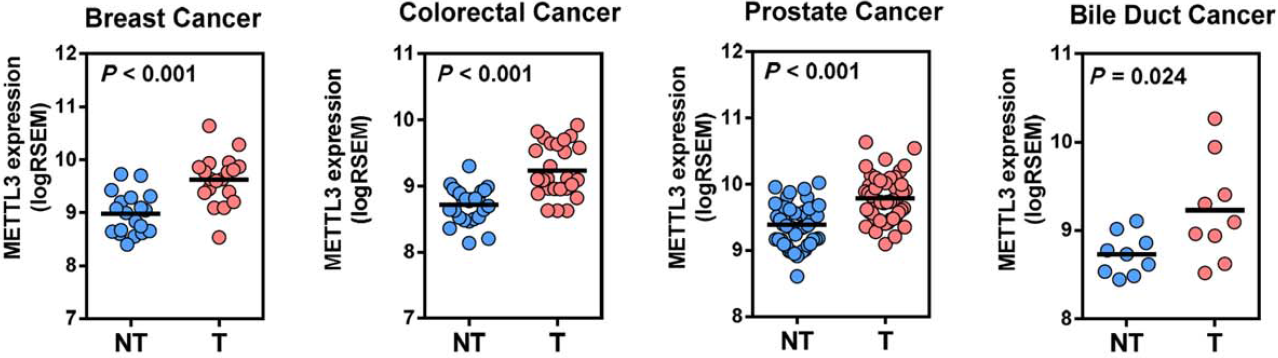
作者下一步挖掘了TCGA数据后发现,比较容易发生转移的肿瘤,如乳腺癌、结直肠癌、前列腺癌和胆管癌中,肿瘤组织中METTL3表达量比癌旁组织显著上升。
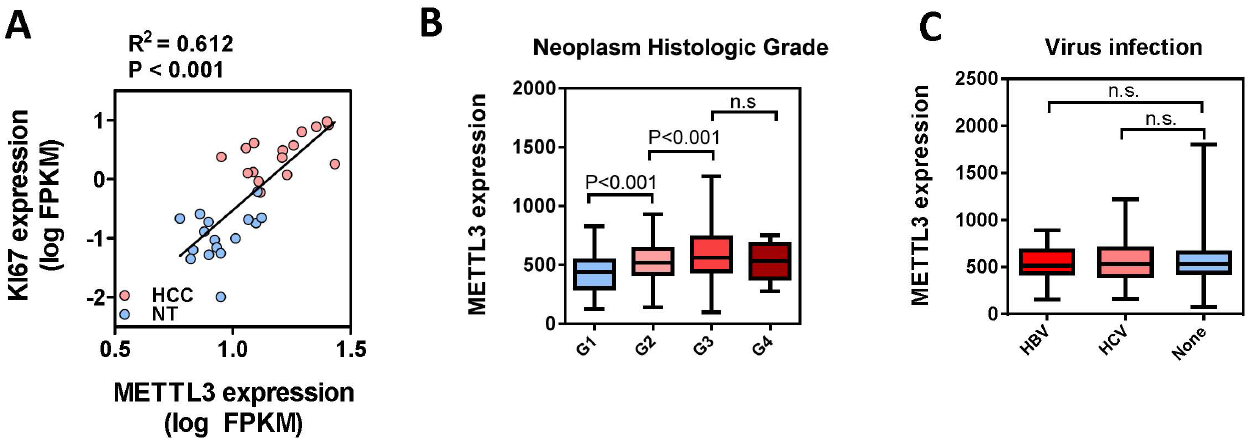
肝癌中ki67作为一个很重要的指标,与METTL3相关性高度吻合。METTL3在肝癌不同分期中,G1、G2和G3逐渐显著上升,而G3和G4差异不大。但是无论是乙肝病毒、丙肝病毒还是未感染任何病毒,METTL3都差异不大。
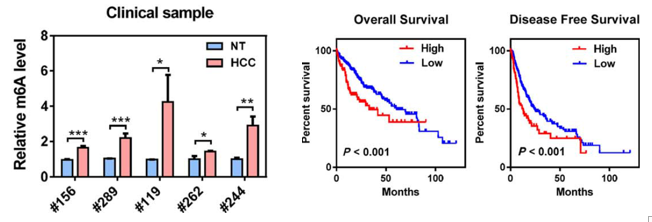
不同病人的样本中我们可以看到RNA整体的m6A水平在肝癌组织中显著高于癌旁组织。生存曲线表明,METTL3高表达水平与病人较低的生存周期相关。
4.敲低METTL3抑制HCC生长和转移
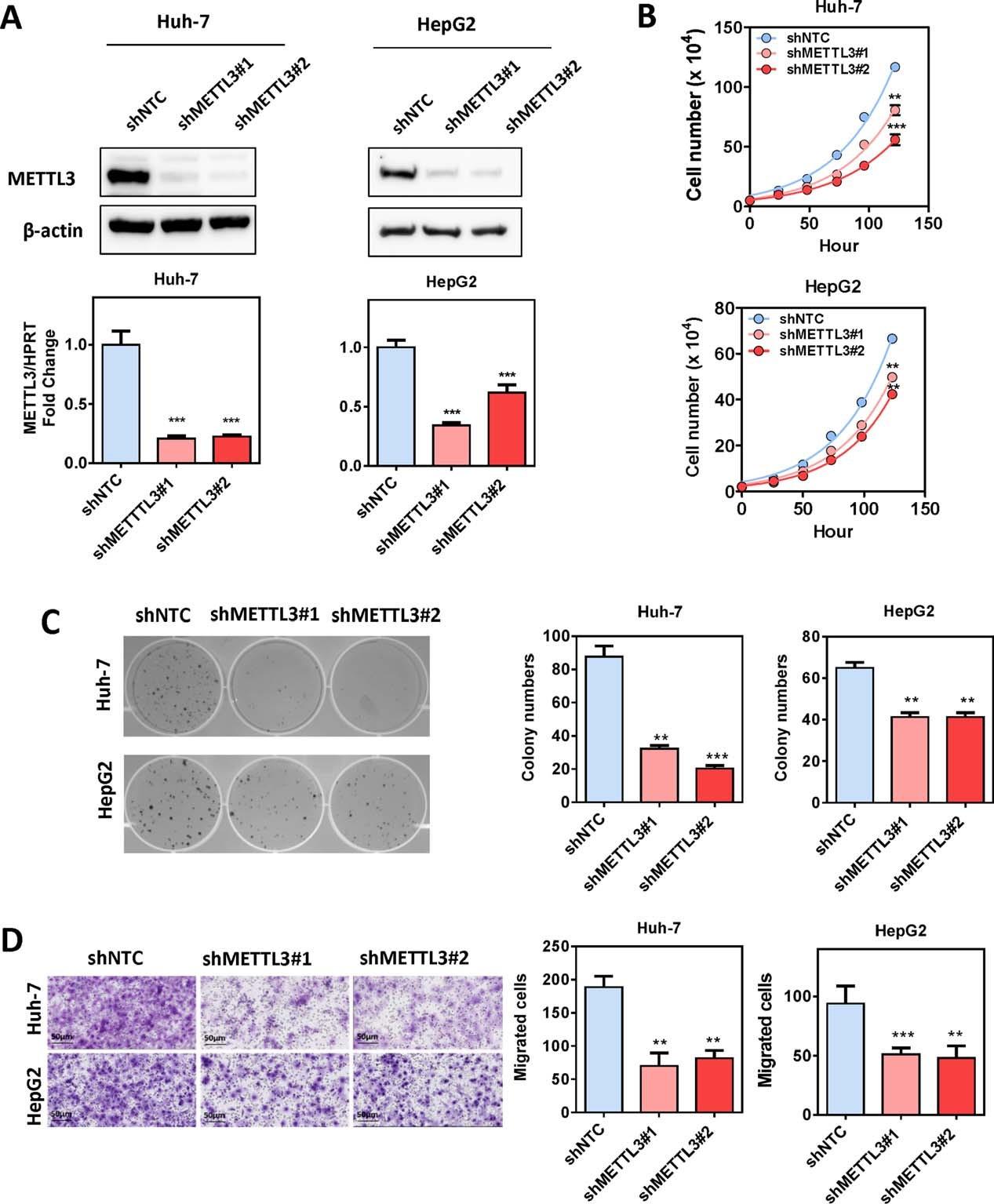
Huh-7和HepG2细胞系中敲低METTL3后同时降低了mRNA和蛋白表达水平,抑制了细胞增殖和迁移。
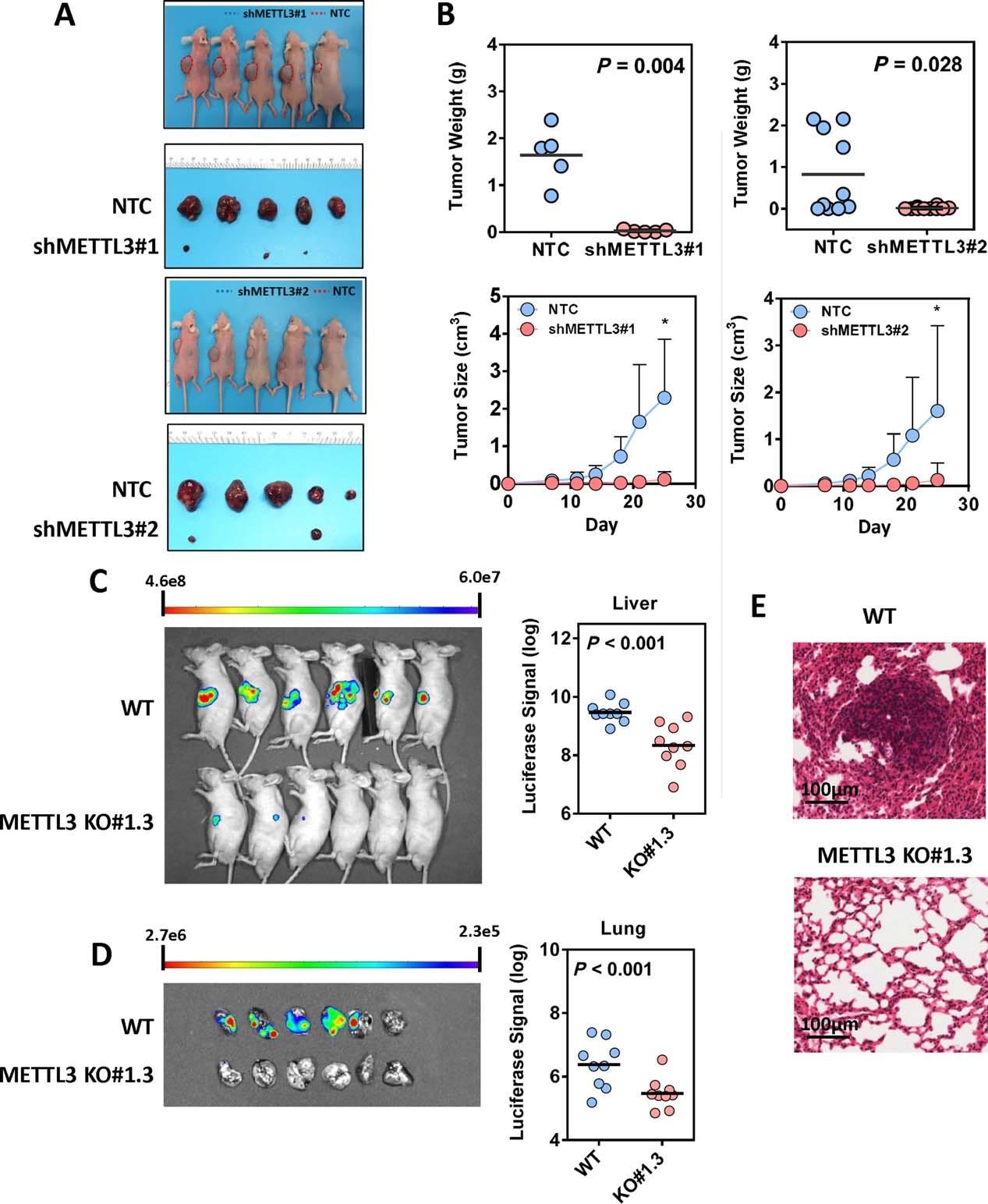
在裸鼠中敲低METTL3,肿瘤组织重量减轻了。METTL3敲除能够显著抑制小鼠肝肿瘤微环境中肿瘤形成,裸鼠肺转移减弱。
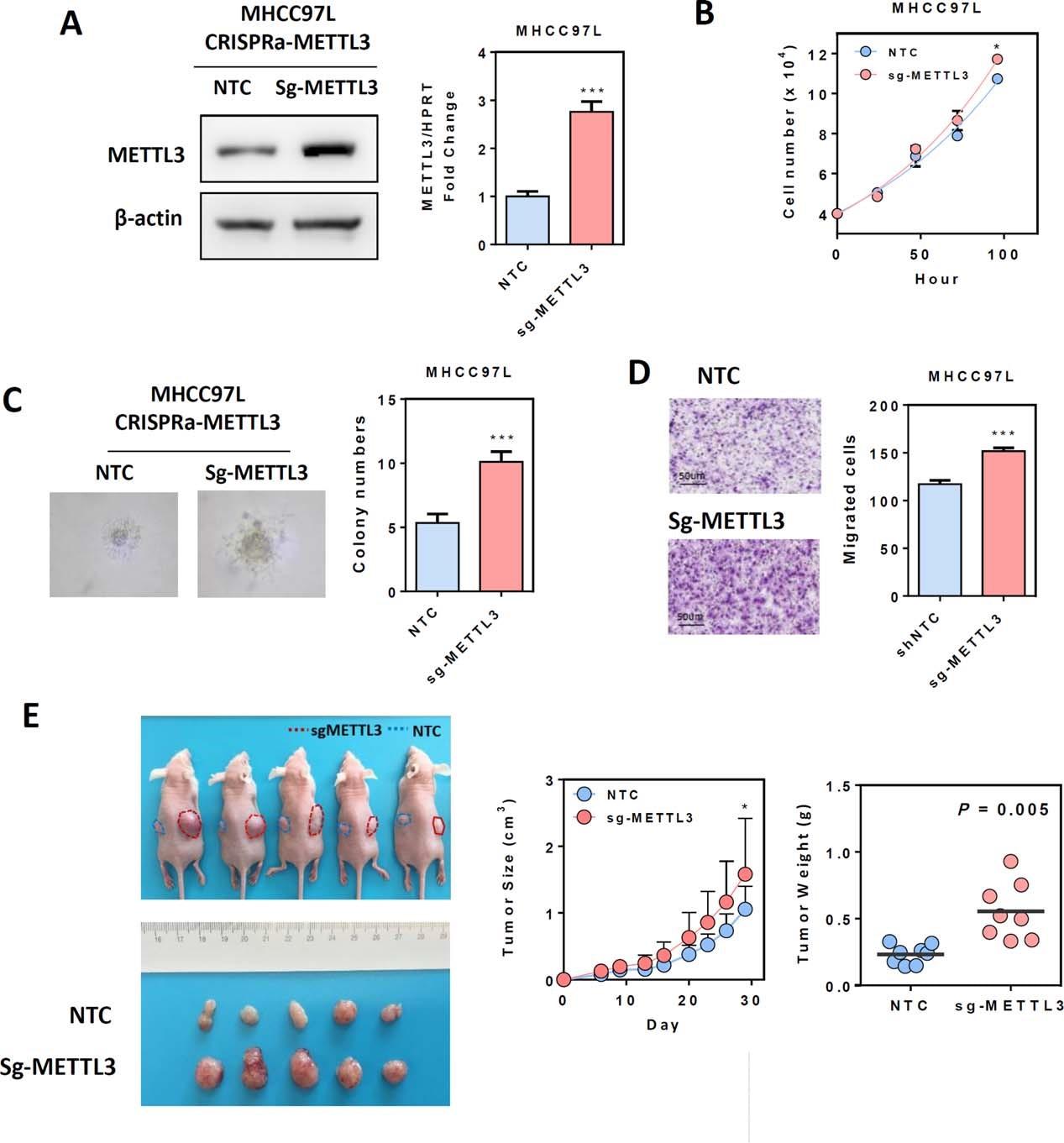
使用CRIPSR-dcas9激活METTL3的promoter区后,METTL3在基因和蛋白水平,促进HCC细胞增殖和迁移水平。下一步作者将METTL3过表达的细胞对裸鼠进行皮下注射后,肿瘤组织重量显著增加。所以作者最后推测METTL3可能在HCC中具有原癌作用(oncogenic role)。

作者在Huh-7和HepG2细胞系中采用两种shRNA进行敲低后进行了转录组测序,分别鉴定到了515和320个差异基因在2个细胞系中上调。功能富集分析表明差异基因大量富集在细胞分化、细胞粘附、外部刺激、细胞迁移分化等功能上。这表明m6A修饰能够影响下游大量的基因功能。由于细胞株之间的差异较大,取交集后只有15个基因是共同发生上调的,其中根据先前的研究,作者将SOCS2作为候选基因。
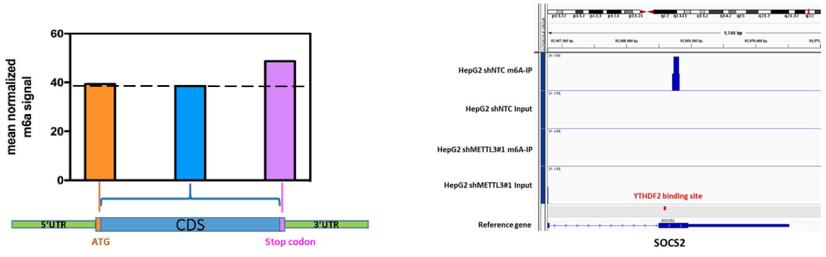
下一步,作者进行了m6A测序,发现与先前报道类似,peak基本富集在3’ UTR和终止密码子附近。其中在Control的细胞系中,SOCS2的3’UTR出现了高强度信号的peak峰,而在shRNA干扰的细胞中SOCS2的3’ UTR区和终止密码子peak峰信号明显弱于Control的细胞系。
作者认为METTL3的靶基因就是SOCS2。
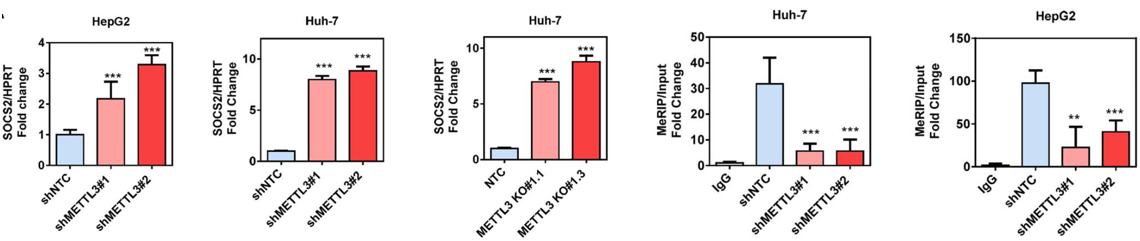
作者使用RT-qPCR证实细胞系中敲低和敲除METTL3后,能够引起SOCS2表达量显著上升。而MeRIP-qPCR也证实敲低METTL3后SOCS2上m6A水平显著降低。
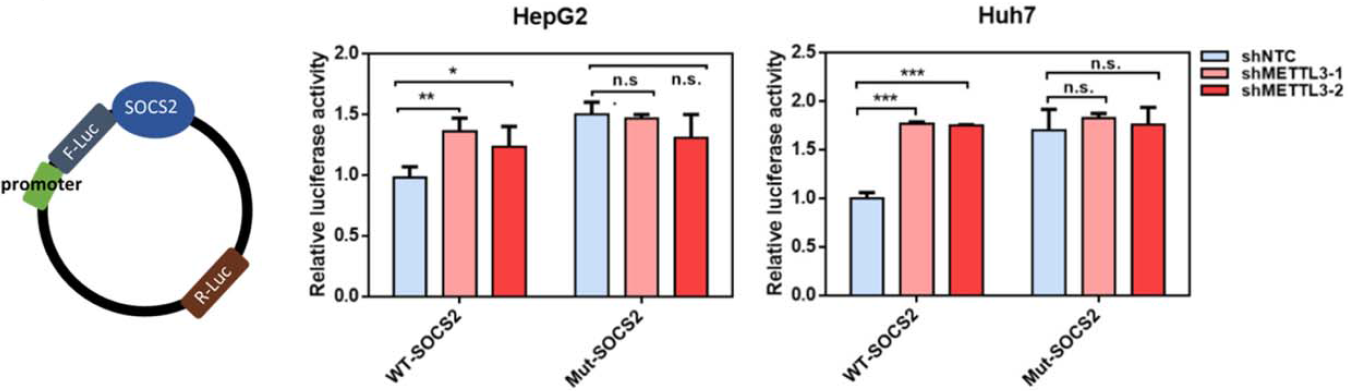
作者对SOCS2的序列中RRACH motif内A碱基替换成C,采用荧光素酶报告基因系统验证m6A修饰对SOCS2基因表达量的影响。结果表明WT中荧光素酶报告强度显著降低,而mut中差别不大。意味着WT中带有m6A修饰的SOCS2基因会被YTHDF2降解,而METTL3行使的m6A催化功能尤其关键。
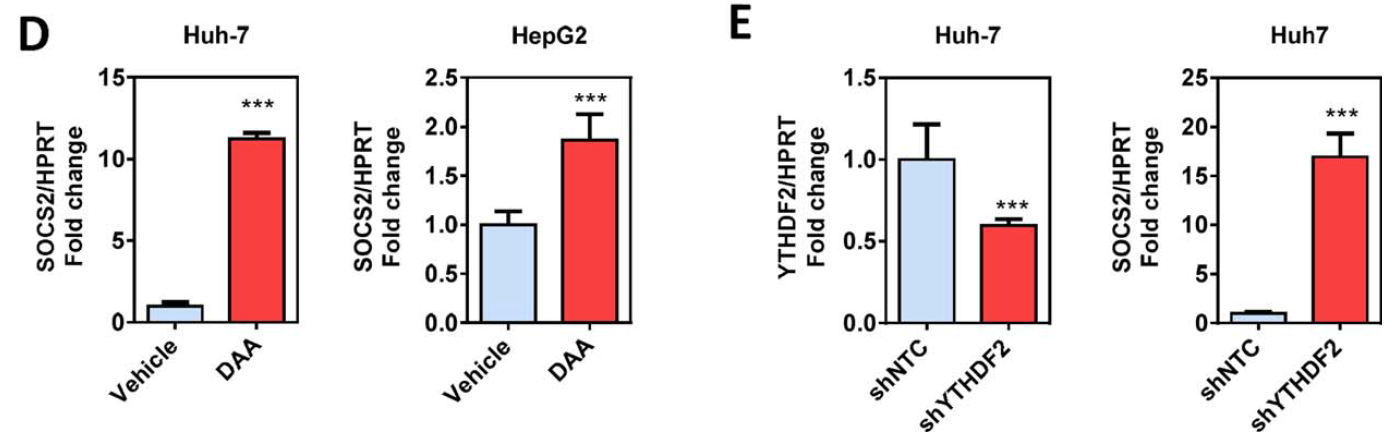
作者加入了m6A甲基化抑制剂3‐deazaadenosine后,SOCS2表达量也显著上升。下一步作者挖掘了先前其他文献中已报到的CLIP-seq数据发现YTHDF2能够直接靶向SOCS2。这个结果与作者自己的m6A测序数据也相吻合。因此作者推测SOCS2降解由YTHDF2直接介导。
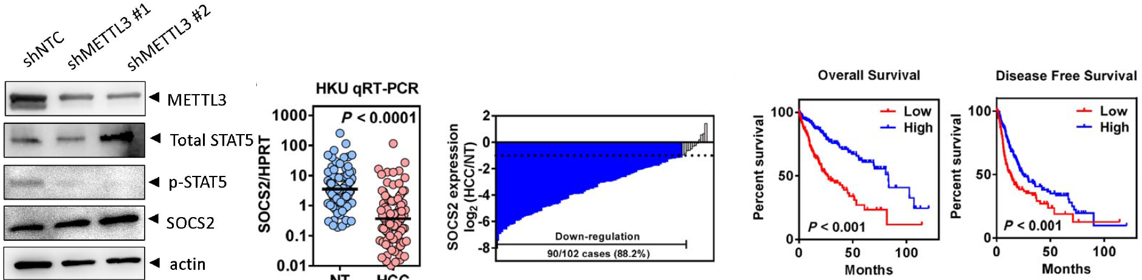
SOCS2是细胞因子信号转导家族的抑制蛋白,是JAK/STAT通路的负调控因子。作者发现敲低/敲除METTL3后SOCS2表达量显著上升,从而抑制信号转换STAT的磷酸化。102人的HCC队列进行了RT-qPCR,证实癌旁组织中SOCS2表达量显著高于癌症组织。SOCS2低表达,HCC预后更差,生存周期更短。

敲低SOCS2促进Huh-7细胞的增殖和迁移。TCGA中挖掘出来的数据表明,METTL3和SOCS2呈现负相关。
这项工作有意思的点在于,孙树汉课题组(案例解析:RNA甲基化转移酶METTL14影响肝癌转移)曾报道METTL14在HCC中表达量显著降低引起抑癌分子miR-126成熟体表达量下降,从而促进HCC的恶化。但是本文的作者颇具“挑衅”地将一系列METTL14的数据show在了论文内,并证实了METTL14并没有在HCC中表达量显著降低。另外作者提到了其他两种酶RBM15B和KIAA1429在HCC中的表达量也显著提升(数据未显示)。作者猜测很有可能这些writers形成的complex复合物在共同行使m6A的催化功能,这无疑更加坚定支持了m6A修饰水平上升会促进HCC恶化这一结论。
为了敲实METTL14的功能,作者还特意“贴心”地补充了一个METTL14在HCC中的功能。即在Huh-7细胞中采用两种shRNA对METTL14进行了敲低。然而结果表明Huh-7细胞增殖迁移等功能得到了抑制。采用CRISPR-vCas9系统与前面的实验操作相似,激活METTL14的表达水平后促进了Huh-7细胞的增殖迁移功能。
不过作者在最后并没有完全否定孙树汉课题组的结果,在讨论的后半段给予了一定的回旋余地,即m6A调控是一个相对复杂的机制,目前仍需更多的研究来支持这些看似矛盾的结果。
Chen M, Wei L, Law C, et al. RNA N6-methyladenosine methyltransferase-like 3 promotes liver cancer progression through YTHDF2-dependent posttranional silencing of SOCS2.Hepatology. 2018 Jun
相关阅读推荐:
m6A甲基化整体研究思路:m6A相关SCI论文发表要求分类汇编
地 址: 杭州经济技术开发区下沙6号大街260号中自科技园16幢4层 联系人: 吴先生 电 话: 0571-87662413 传 真: 0571-81951905 Email:market@lc-bio.com
快来围观,你离高分paper还差一个phasiRNA
(2019-01-14T13:34 浏览数:4359)
如何选择合适的qRT-PCR内参基因?
(2019-01-14T11:06 浏览数:18102)
为什么要做绝对定量测序-数据分析
(2018-09-21T17:59 浏览数:4166)
低通量单碱基m6A验证的新方法|m6A专题
(2018-09-18T16:04 浏览数:4167)
祝贺联川客户继Nature后又发一篇Nature Genetics
(2018-09-18T16:03 浏览数:3951)
联川生物八月份客户文章汇总
(2018-09-18T16:02 浏览数:2869)
联川生物七月份客户文章汇总
(2018-09-18T16:01 浏览数:2842)
肝硬化与肝纤维化研究进展
(2018-09-18T16:01 浏览数:10634)
【用户案例】感染鲫鲤疱疹病毒2的银鲫中miRNA的差异表达
(2018-09-18T16:00 浏览数:2885)
病毒m6A专题 | HIV感染宿主促进病毒及T细胞m6A修饰
(2018-09-18T16:00 浏览数:3442)
联川生物技术公司
商家主页
相关咨询
